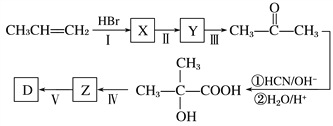
-
将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池。该电池负极发生的反应为( )
A. Ag++e—===Ag
B. Cu-2e—===Cu2+
C. Cu2++2e—===Cu
D. 2H++2e—===H2↑
难度: 简单查看答案及解析
-
用NA表示阿伏伽德罗常数,下列叙述正确的是
A. 标准状况下,22.4 L H2O含有的分子数为1NA
B. 常温常压下,1.06 g Na2CO3含有的分子数为0.02 NA
C. 标准状况下,NA个CO2分子占有的体积约为22.4 L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl—个数为1NA
难度: 困难查看答案及解析
-
下列反应属于加成反应的是
A. 乙烯使溴水褪色
B. 甲烷与氯气在光照条件下的反应
C. 苯和液溴在铁作催化剂的条件下反应
D. 乙酸和乙醇反应生成乙酸乙酯
难度: 中等查看答案及解析
-
为有效防控雾霾污染,我们提倡使用清洁能源。下列属于清洁能源的是
A. 煤 B. 汽油 C. 水电 D. 柴油
难度: 中等查看答案及解析
-
当光束通过下列分散系时,能产生丁达尔效应的是:
A.白酒 B.食醋 C.豆浆 D.矿泉水
难度: 简单查看答案及解析
-
近几年,长沙市已经陆续建成了几条横跨湘江的过江隧道,在工程建设中用量最大的硅酸盐材料是
A. 钢筋 B. 水泥 C. 玻璃 D. 陶瓷
难度: 中等查看答案及解析
-
从不含杂质的氯化钠溶液中获得氯化钠晶体,采用的操作是
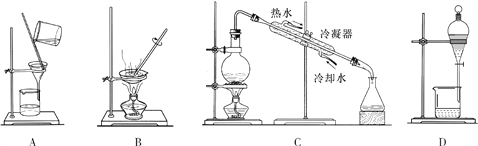
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组离子,能在溶液中大量共存的是
A. H+、OH- B. Ba2+、SO
C. Al3+、OH- D. K+、Cl-
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述。下列有关化学用语不正确的是
A. CO2的电子式:
··C··
B. Cl-的结构示意图:
C. 乙烯的结构简式:CH2 D. 原子核内有20个中子的氯原子:
Cl
难度: 中等查看答案及解析
-
下列物质中,不能发生水解反应的是
A. 葡萄糖 B. 油脂 C. 纤维素 D. 蛋白质
难度: 中等查看答案及解析
-
高炉炼铁的主要反应是Fe2O3+3CO
2Fe+3CO2,该方法在冶金工业上被称为
A. 电解法 B. 热还原法
C. 热分解法 D. 铝热法
难度: 中等查看答案及解析
-
下列说法正确的是
①化合反应一定是氧化还原反应 ②复分解反应都不是氧化还原反应 ③有单质生成的分解反应一定是氧化还原反应 ④置换反应一定是氧化还原反应
A. ①②④ B. ①②③ C. ②③④ D. ①②③④
难度: 中等查看答案及解析
-
已知反应:2H2O2=2H2O+O2↑,下列条件下,反应速率最大的是
A.10℃,5mL 3 %H2O2溶液
B.10℃,5mL 5 %H2O2溶液
C.30℃,5mL 5%H2O2溶液
D.30℃,5mL 5 %H2O2溶液且加入少量MnO2
难度: 简单查看答案及解析
-
下列物质中,只含有离子键的是
A. Na2O2 B. NaCl C. HCl D. NaOH
难度: 中等查看答案及解析
-
下列物质中,属于电解质的是
A. 铜 B. 盐酸 C. 碳酸钙 D. 二氧化碳
难度: 中等查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是 ( )
A. R的原子半径比Z的大 B. R的氢化物的热稳定性比W的强
C. X与Y形成的化合物只有一种 D. Y的最高价氧化物的水化物的酸性比W的强
难度: 中等查看答案及解析
-
下列关于乙烯和氯乙烯相同点的说法不正确的是
A. 都属于有机物中的烃类 B. 都含有双键而具有不饱和性
C. 都可发生加聚反应 D. 都是重要的化工生产原料
难度: 中等查看答案及解析
-
下列微粒中,没有氧化性的是
A. Cl- B. H+ C. Cl2 D. HClO
难度: 中等查看答案及解析
-
为了检验某FeCl2溶液是否氧化变质,可向溶液中加入
A. NaOH溶液 B. 铁片
C. 稀H2SO4 D. KSCN溶液
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 石墨和金刚石互为同位素 B. 乙烷和丙烷互为同素异形体
C. CH3CH2CH2CH3与CH(CH3)3互为同分异构体 D. 12C和13C互为同系物
难度: 中等查看答案及解析
-
“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是
A. nCH2=CH2
B. CH4+2Cl2
CH2Cl2+2HCl
C. Cl2+2NaOH===NaCl+NaClO+H2O
D. 3NO2+H2O===2HNO3+NO
难度: 简单查看答案及解析


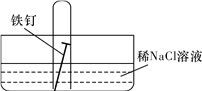


 RBrOHBr。
RBrOHBr。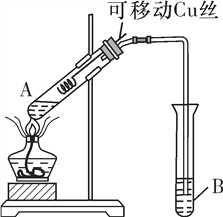

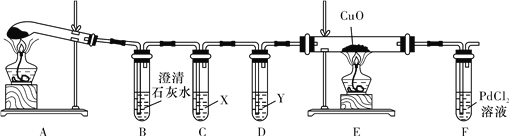
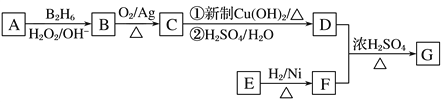
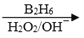 R—CH2CH2OH;
R—CH2CH2OH;