-
下列说法正确的是
A.塑化剂DEHP是指邻苯二甲酸二(2─乙基己)酯,对人体无害,可用作食品添加剂
B.二氧化氮经过加压凝成无色液体为物理变化
C.Na2O·SiO2是一种简单的硅酸盐,可溶于水
D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-) =2NA
B.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA
C.标准状况下,2.24L的CCl4中含有的C—Cl键数为0.4NA
D.将CO2通过Na2O2使其增重a克时,反应中转移电子数为
难度: 中等查看答案及解析
-
下列说法正确的是
A.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
B.分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种
C.
分子中至少有11个碳原子处于同一平面上
D.1mol有机物
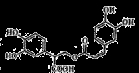 一定条件下能和7molNaOH反应。
一定条件下能和7molNaOH反应。难度: 中等查看答案及解析
-
下列判断错误的是
A.沸点:NH3>PH3>AsH3
B.结合质子的能力:OH->CH3COO->Cl-
C.酸性:HClO4 >H2SO4 >H3PO4
D.碱性:NaOH >Mg(OH)2 >Al(OH)3
难度: 简单查看答案及解析
-
已知A、B为单质,C为化合物。且有如下转化关系
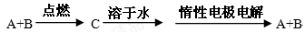
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液与Na2CO3溶液反应,放出CO2气体,则A可能是H2
③若C溶液中滴加NaOH溶液,先生成沉淀后又溶解,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是
A.①② B.②④ C.①③ D.③④
难度: 中等查看答案及解析
-
下列有关溶液组成的描述合理的是
A.在Fe2(SO4)3溶液中可以大量存在: K+、Fe2+、Cl-、Br-、SCN-
B.c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、HCO3-、NO3-
C.加水稀释时c(OH-)/c (H+)值增大的溶液中可大量存在:MnO4-、CO32-、K+、NH4+
D.在碱性溶液中可以大量存在:S2O32- 、AlO2-、SiO32-、S2- 、Na+
难度: 中等查看答案及解析
-
某种聚合物锂离子电池放电时的反应为Lil-xCoO2 + LixC6=6C + LiCoO2,其电池如图所示。下列说法不正确的是

A.放电时,LixC6发生氧化反应
B.充电时,Li+通过阳离子交换膜从左向右移动
C.充电时,将电池的负极与外接电源的负极相连
D.放电时,电池正极反应为Lil-xCoO2+xLi++ xe-=LiCoO2
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的
难度: 简单查看答案及解析
-
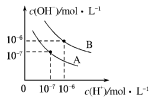
下列有关物质浓度关系的描述中,正确的是
A.25℃时,NaB溶液的pH=9,则c(Na+)-c(B-)=9.9×10-7mol·L-1
B.0.1 mol·L-1的NaHCO3溶液中:c(OH-)+2c(CO32-) =c(H+)+c(H2CO3)
C.25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-) =c(H+)
D.25℃时,将pH均为3的醋酸溶液和盐酸分别加水稀释到pH均为5,则由水电离出的H+的浓度均减小为原来的100倍
难度: 中等查看答案及解析
-
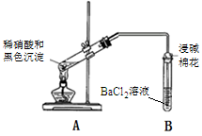
下列解释事实的离子方程式不正确的是
A.酸性KMnO4溶液与H2O2反应:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+8H2O
B.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
难度: 困难查看答案及解析
-
用铂作电极电解1000 mL 0.1 mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4 g。下列有关叙述正确的是(NA代表阿伏加德罗常数的值)
A.电解过程中流经外电路的电子数目为0.1NA
B.在标准状况下,两极共产生3.92L气体
C.电解后溶液的pH为2(假设溶液体积不变)
D.加入13.8 g Ag2CO3可将溶液彻底复原
难度: 中等查看答案及解析
-
近年来化学科学家采用“组合转化”技术,将二氧化碳在一定条件下转化为重要的化工原料乙烯:2CO2(g)+6H2(g)
C2H4(g)+4H2O(g);△H=+1411.0 kJ/mol,关于该反应,下列图示与对应的叙述相符的是
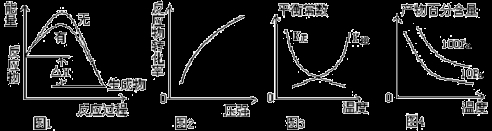
A.图1表示该反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示一定条件下反应达到平衡后改变压强反应物的转化率的变化
C.图3表示一定条件下反应达到平衡后改变温度反应平衡常数的变化
D.图4 表示一定条件下反应达到平衡后改变温度、压强产物百分含量的变化
难度: 中等查看答案及解析
-
完成下列实验所选择的装置或仪器(夹持装置部分已略去)正确的是
A
B
C
D
实
验
分离Na2CO3溶液和CH3CH2OH
除去Cl2中含有的少量HCl
做Cl2对NaOH溶液的喷泉实验
制取少量氨气
装
置
或
仪
器
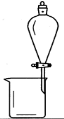
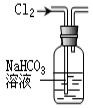
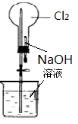
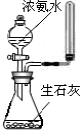
难度: 中等查看答案及解析
-
下列各项中“操作或现象”能达到预期“实验目的”的是
选项
目 的
操作或现象
A
制备无水FeCl3
将FeCl3溶液加热蒸干
B
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
C
证明非金属性Cl>C>Si
向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀
D
测定NaCl中混有Na2CO3的量
取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.已知:HI(g)
H2(g)+
I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量
B.已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-285.8 kJ/mol
C.肼(N2H4)是一种用于火箭或燃料电池的原料,已知
2H2O(g) + O2(g)=2H2O2(l) △H= +108.3kJ/mol ①
N2H4(l) + O2(g)=N2(g) + 2H2O(g) △H=-534.0kJ/mol ②
则有反应:N2H4(l) + 2 H2O2(l) = N2(g) + 4H2O(l) △H=-642.3kJ/mol
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) = CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
难度: 中等查看答案及解析
-
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况)
B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL
C.原稀硝酸的物质的量浓度一定为4 mol/L
D.参加反应金属总质量(m)为9.6g>m>3.6g
难度: 困难查看答案及解析