-
化学在生产和日常生活中有着重要的作用。下列说法中不正确的是
A.Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂
B.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用
C.常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道泄漏情况
D.开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理
难度: 简单查看答案及解析
-
某氖原子的质量是a g,12C原子的质量是bg用NA表示阿伏加德罗常数,则以下叙述中错误的是
A.该氖原子的相对原子质量为12a/b
B.Wg该氖原子的物质的量为W/aNA mol
C.Wg 该氖原子所含的质子数为 10W/a个
D.氖元素的摩尔质量为aNA g/mol
难度: 简单查看答案及解析
-
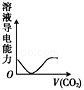
下列实验过程中产生的现象与对应的图形相符的是
A.NaHSO3 粉末加入HNO3溶液中

B.SO2气体通入H2S溶液中
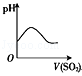
C.NaOH溶液滴入Ca(HCO3)2溶液中
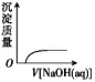
D.CO2气体通入NaOH溶液中
难度: 中等查看答案及解析
-
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5+xLi
LixV2O5。下列说法合理的是
A.电池在放电时,Li+向负极移动
B.锂在放电时作正极,充电时作阳极
C.该电池充电时阳极的反应为LixV2O5 _ xe-=V2O5 + xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
难度: 中等查看答案及解析
-
在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)
1/2N2(g)+CO2 (g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率和该反应的速率,可采取的措施是
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
难度: 中等查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
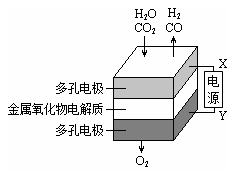
A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ
C.总反应可表示为:H2O+CO2 = H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是2︰1
难度: 中等查看答案及解析
-
将2.4g Fe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。则收集到的气体体积V的值不可能为
A.1.02 B.1.68 C.1.00 D.0.986
难度: 中等查看答案及解析
-
下列有关NaClO和NaCl混合溶液的叙述正确的是
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+ = Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
难度: 困难查看答案及解析
-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应。下列说法错误的是
A.元素丙的单质可用于冶炼金属
B.甲与丁形成的分子中有非极性分子
C.简单离子半径:丁 > 乙 > 丙
D.甲与乙形成的化合物均有强氧化性
难度: 中等查看答案及解析
-
下列说法正确的是
A.增大压强,活化分子百分数增加,化学反应速率一定增大
B.升高温度,单位体积内分子总数不变,但活化分子数增加了
C.分子间所有的碰撞为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率增大
难度: 中等查看答案及解析
-
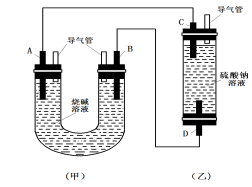
用如图所示的实验装置进行实验X及Y时,每隔半分钟分别测定放出气体的体积。下列选项中正确表示实验X及Y的结果的是
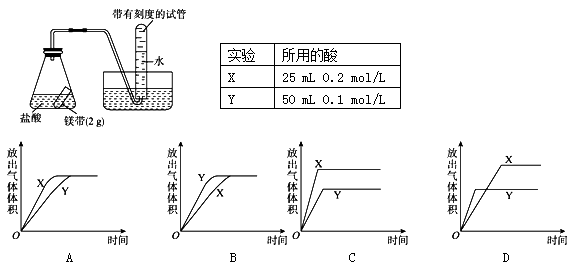
难度: 中等查看答案及解析
-
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
难度: 中等查看答案及解析
-
下列各图所示的实验原理、方法、装置或操作,其中正确的是
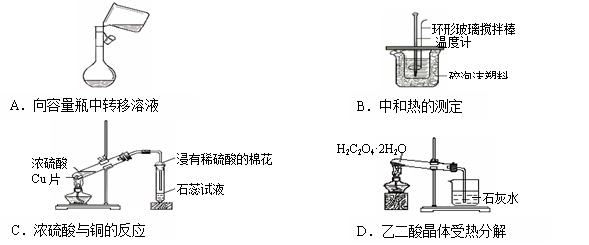
难度: 中等查看答案及解析
-
在给定条件下,下列画线物质在化学反应中能被完全消耗的是
A.用浓盐酸与二氧化锰共热制氯气
B.标准状况下,将1 g铝片投入20 mL 18 mol·L-1硫酸中
C.向100 mL 4 mol·L-1硝酸中加入5.6 g 铁
D.在5×107 Pa、500 ℃和铁触媒催化的条件下,用氮气和氢气合成氨
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是

A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
难度: 中等查看答案及解析
-
维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的A(g)
B(g)+C(g)反应。已知A的平衡转化率为α,则在该温度下反应的平衡常数K为(用α等符号表示)。
A. nα2/(1 -α) V B.nα2/(1 –α2) V C.nα2/(1+α2) V D.nα2/(1 +α) 2V
难度: 中等查看答案及解析
-
在硫化氢的水溶液中,存在以下平衡:H2S
HS-+H+、HS-
H++S2-,若使溶液的pH减小,则c(S2-)
A.增大 B.减小 C.不变 D.可能增大也可能减小
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大
B.常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同
C.向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变
D.常温下,2NO(g)+2CO(g)=N2(g)+2CO2(g)能自发进行,则该反应的△H>0
难度: 中等查看答案及解析
-
已知:在一定温度下,H2(g) + I2(g)
2 HI(g)的平衡常数为K1;1/2H2(g) + 1/2I2(g)
HI(g)的平衡常数为K2,则K1、K2的关系为
A.K1=K2 B.K1=2K2 C.K1=1/2K2 D.K1=K22
难度: 简单查看答案及解析
-
在恒温、恒容下,发生如下反应:2A(g)+2B(g)
C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是
A、达到平衡时,途径I的反应速率等于途径Ⅱ的反应速率
B、达到平衡时,途径I所得混合气体的压强等于途径Ⅱ所得混合气体的压强
C、两途径最终达到平衡时,体系内各组分的百分含量相同
D、两途径最终达到平衡时,体系内各组分的百分含量不相同
难度: 困难查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
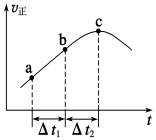
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
难度: 中等查看答案及解析
-
如图所示为气相直接水合法C2H4(g)+H2O(g)
C2H5OH(g)中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
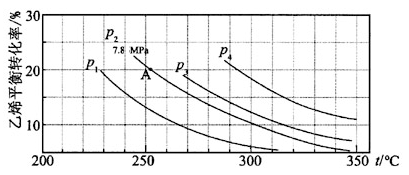
计算乙烯水合制乙醇反应在图中A点的平衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
A.0.082 B.0.072 C.0.072MPa-1 D.0.082 MPa-1
难度: 中等查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g) △H=+QkJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行上述反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好反应
难度: 中等查看答案及解析
-
CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+ Br2(g) △H=+105.4kJ/mol在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为
A.p(Br2)≤4.66×103Pa B.2.33×103Pa< p(Br2)≤4.66×103Pa
C.p(Br2)﹥2.33×103Pa D.2.33×103Pa≤p(Br2)≤4.66×103Pa
难度: 中等查看答案及解析