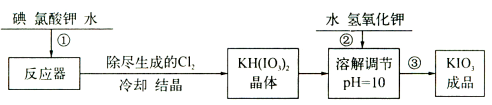
-
下列说法正确的是
A.CO2的水溶液能导电,所以CO2是电解质
B.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
C.液溴不导电,所以溴是非电解质
D.BaSO4难溶于水,其水溶液的导电能力极弱,所以BaSO4是弱电解质
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.二氧化碳结构式:O-C -O
B.S2-的结构示意图:

C.中子数为146、质子数为92的铀(U)原子
D.NH5的电子式为:
难度: 中等查看答案及解析
-
下列说法正确的是
A.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
B.氢氧化钠固体保存在带橡胶塞的广口瓶中
C.二氧化硅不与任何酸反应,可用石英制造耐酸容器
D.少量金属钠保存在煤油、四氯化碳等有机溶剂中
难度: 中等查看答案及解析
-
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从小到大的是
A.p (Ne) < p (H2) < p (O2) B.p (H2) < p (O2) < p (Ne)
C.p (O2) < p (Ne) < p (H2) D.p (H2) < p (Ne) < p (O2)
难度: 中等查看答案及解析
-
下列叙述正确的是
A.阳离子都只有氧化性
B.分子晶体中一定存在分子间作用力
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
难度: 中等查看答案及解析
-
有下列符号:35Cl和37Cl、O2和O3、
。下列有关说法正确的是
A.35和37表示的是质量数 B.35Cl和37Cl互称为同素异形体
C.O2和O3是氧元素的两种同位素 D.
的相对分子质量相同
难度: 中等查看答案及解析
-
下列实验设计或实验操作中,正确的是
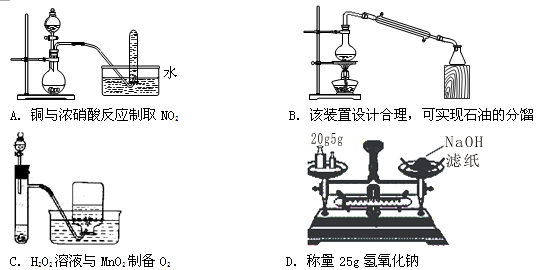
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑
B.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O
C.漂白粉溶液中通入少量SO2气体:Ca2+ +2ClO- +SO2 +H2O =CaSO3↓+2HClO
D.Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O
难度: 困难查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是
A.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水
B.Na2FeO4既是氧化产物又是还原产物
C.Na2O2在上述反应中只作氧化剂
D.2 mol FeSO4发生反应时,共有10 mol电子发生转移
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.元素Y、Z、W的单质晶体属于同种类型的晶体
C.元素W和M的某些单质可作为水处理中的消毒剂
D.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A.pH=13的溶液中:AlO2-、CO32-、NO3-、Na+
B.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
C.含大量Al3+的溶液中:K+、NH4+、NO3-、HCO3-
D.在由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Ba2+、CO32-、ClO-、Na+
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1mol二氧化硅晶体中含有4NA个硅氧键
B.100mL 18.4mo1·L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA
C.0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
D.将0.l mol FeC13滴入沸水中可制得0.1NA Fe(OH)3胶粒
难度: 中等查看答案及解析
-
下列实验不能达到预期目的的是
序号
实验操作
实验目的
A
Cl2、Br2分别与H2反应
比较氯、溴的非金属性强弱
B
用同一电路测定等浓度的盐酸、醋酸两溶液的导电性
比较盐酸、醋酸的相对强弱
C
测定Na2CO3、Na2SO4两溶液的pH
比较碳、硫的非金属性强弱
D
MgCl2、AlCl3溶液中分别通入NH3
比较镁、铝的金属性强弱
难度: 中等查看答案及解析
-
SO2通入足量Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程中,下列说法中不正确的是
A.上述过程中,最终被还原的是NO3—
B.从上述过程中可以得出结论,氧化性:HNO3>Fe3+>稀H2SO4
C.假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为1∶1
D.上述过程中,会产生一种无色无味的难溶于水的气体
难度: 中等查看答案及解析
-
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如右图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是
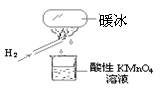
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.该条件下H2燃烧的产物中可能含有一定量的H2O2
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
难度: 中等查看答案及解析
-
下列说法正确的是
A.已知
则可以计算CH3—CH3 → CH2=CH2+H2;ΔH =+125.6 kJ/mol
B.能说明NH3结合H+能力比H2O强:NH3+H3O+=NH+4+H2O
C.已知下列热化学方程式:2H2(g)+O2(g) === 2H2O(g) △H=-484kJ/mol,则氢气的燃烧热为-242kJ/mol
D.已知中和热为-57.4kJ/mol ,则NaOH(aq) +CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H =-57.4kJ/mol
难度: 中等查看答案及解析
-
往含等物质的量的偏铝酸钠与氢氧化钠的混合溶液中通入二氧化碳,产生沉淀的量与通入二氧化碳的量关系正确的是
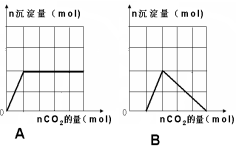
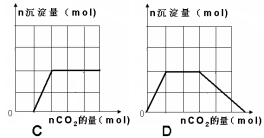
难度: 中等查看答案及解析
-
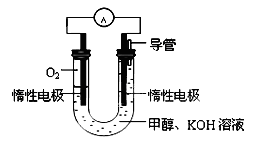
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
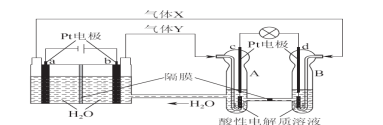
A.转移0.1mol电子时,a电极产生1.12LH2
B.b电极上发生还原反应
C.酸性电解质溶液中H+移向c电极
D.d电极上发生的电极反应是:O2+4H++4e-===2H2O
难度: 中等查看答案及解析
-
在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l), △H2
B.H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2
C.C(s)+1/2O2(g)=CO(g),△H1; C(s)+O2(g)=CO2(g), △H2
D.S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g), △H2
难度: 中等查看答案及解析
-
某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按下图所示方法分离和提取金属单质:
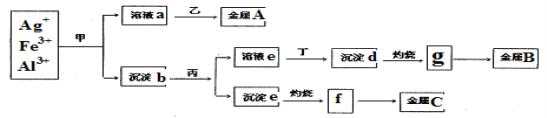
已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备。对该实验分析正确的是
A.甲是氢氧化钠,丁为稀硫酸
B.沉淀b为混合物,主要成分为沉淀d和沉淀e
C.g、f都为氧化物,工业上均采用电解g与f获得对应金属单质
D.金属A、B、C分别为Ag、 Fe、Al
难度: 中等查看答案及解析