-
(12分) 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”)。
②已知反应Ⅰ的能量变化如图所示: 由表中数据判断 ΔH1________0 (填“>”、“=”或“<”)。

③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L, 则CO的转化率为________
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为________
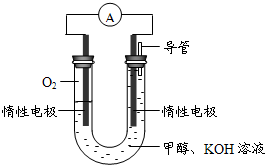
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
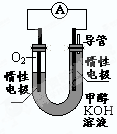
①该电池正极的电极反应为____________
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为____________.
-
(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
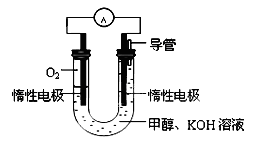
①工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。
②用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为 mol/L(假设电解前后溶液体积不变)。
-
甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H=a kJ/mol,
CH3 OH(g) △H=a kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
| 温度/0C | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
(1)由表中数据判断△H a________0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5 mol·L-1,则此时的温度为________0C。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 浓度mol/L 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①反应从2 min到4 min之间,H2的反应速率为________。
②反应达到平衡时CO的转化率为________。
③反应在第2 min时改变了反应条件,改变的条件可能是________(填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g)  CH3 OH(g)△H=a kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H=a kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
w1________w2(填序号)。
A.大于 B.小于 C.等于 D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式:________。
-
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是______(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1______0 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______
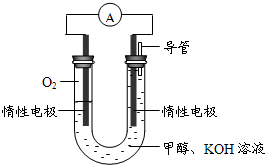
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为______.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为______.
-
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
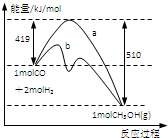
如图所示是反应I反应过程中的能量变化曲线.
(1)由图可知反应I为______反应(选填”吸热、放热”),反应热△H1=______.
(2)反应I在一定体积的密闭容器中进行,能判断其是否达到化学平衡状态的依据是______.
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(CH3OH)
D.c(CO)=c(CH3OH)
(3)图中曲线______表示使用催化剂时反应的能量变化.
(4)一定条件下,向体积为2L的密闭容器中充入2mol CO2和6mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数数K值=______(用分数表示),若开始时充入2mol CH3OH(g) 和2mol H2O(g)达到相同平衡时CH3OH的转化率为______,若平衡后在充入4mol的N2,则c(CO2)是______.
(5)从绿色化学的角度比较上述两种方法,符合原子经济的是______.(填“Ⅰ”或“Ⅱ”)
-
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是______(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1______0 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为______.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为______.
-
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:反应I:CO(g)+2H2(g)═CH3OH(g)
反应II:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)= 2CO2(g)+ 4H2O(g) △H=﹣1275.6kJ/mol
②2CO (g)+O2(g)= 2CO2(g) △H=﹣566.0kJ/mol
③H2O(g)= H2O(l) △H=﹣44.0kJ/mol
则CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) △H=
(3)3.2g 甲醇中所含共价键的物质的量为 ,完全燃烧该质量的甲醇可放出 kJ的热。
(4)已知某条件下,8g氧气所占的体积为8L,则在该条件下0.2mol甲醇气体所占的体积为 L,完全燃烧等量甲醇时转移了 mol电子。
-
能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(1)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g)⇌CH3OH(g)△H2
①下列条件中,能说明反应A达到平衡状态的是________.
A.生成甲醇的速率与生成水的速率相等 B.v(H2)/3=v(CH3OH)
C.恒容容器中,体系的压强不再改变 D.恒容容器中,混合气体密度不再发生改变
②在一定的压强下,将CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则
△H2________0,△S________0(填“>”、“=”或“<”).
③对于反应B,若容器容积不变,下列措施可增加甲醇产率的是________.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.按原比例再充入CO和H.
④某温度下,将2mol CO和6mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为________,则该温度下该反应的平衡常数为________.
(2)已知在常温常压下:
①2CH3OH(I)十3O2(g)=CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2 (g)═2CO2 (g)△H=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ.mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式________.
-
(8分)、能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
⑴工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) H1
H1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) H2
H2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”);
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断 H1________0(填“>”“=”或“<”);
H1________0(填“>”“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为________,此时的温度
为(从上表中选择)
⑵将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4(g)+3/2O2(g) CO(g)+2H2O(g)
CO(g)+2H2O(g) H=-519kJ·mol-1。工业上,为选择合适的催化剂,分别对X、Y、Z三 种催化剂进行了如下实验(其他条件相同)
H=-519kJ·mol-1。工业上,为选择合适的催化剂,分别对X、Y、Z三 种催化剂进行了如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1> T2> T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是________(填“X”、“Y”或“Z”)选择的理由是________。
-
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 ________0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,5min后该反应达到平衡,测得c(CO)= 0.2 mol/L,则用H2表示的该反应的反应速率为:________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。 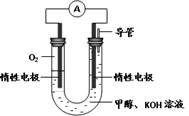
①该电池正极的电极反应为________。
② 用该电池电解200mL饱和食盐水(溶质足量),一段时间后,阴极得标况下气体2.24L,电解后溶液的pH为________(溶液体积变化忽略不计),要使电解后溶液复原,所加物质为(填名称)。
CH3OH(g) ΔH1
CH3OH(g) + H2O(g) ΔH2





