-
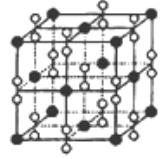
化学与生活、社会密切相关,下列说法正确的是 ( )
A.合金的许多性能优于其组成成分,如硬度都会增大,熔点都会升高
B.要除去衣服上的顽固污渍,可将衣服泡在漂白液中
C.硅是地壳中含量位居第二的元素,其中玛瑙、光导纤维的主要成分为SiO2
D.工业上获得大量的乙烯、丙烯、丁二烯的方法是石油裂化
难度: 简单查看答案及解析
-
25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+3/2O2(g) = CO2(g) +2H2O(l) △H=-725.8 kJ·mol-1
B.2 CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(l) △H=+1451.6 kJ·mol-1
C.2 CH3OH+O2 = 2CO2+4H2O △H=-22.68 kJ·mol-1
D.CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(g) △H=-725.8 kJ·mol-1
难度: 中等查看答案及解析
-
可逆反应2A(g)+B(g)
2C(g),根据下表中的数据判断下列图像错误的是( )

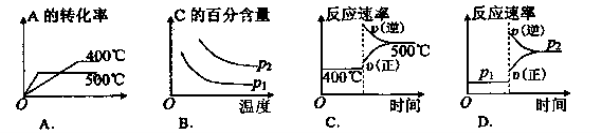
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法不正确的是 ( )
A.12.0g熔融的NaHSO4 中含有的阳离子数为0.1NA
B.常温下,5.6gFe投入到足量浓硝酸中,转移电子数为0.3 NA
C.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2 NA
D.足量的锌与一定量的浓硫酸反应生成1 mol气体时,转移的电子数为2NA
难度: 中等查看答案及解析
-
关于下图电化学装置中的电极名称、材料及反应均可能正确的是
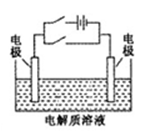
A.阴极(Cu片)2C1――2e-=Cl2↑
B.正极(石墨棒):Fe3+ +e-= Fe2+
C.阳极(Cu片):4OH――4e-=2H2O+O2↑
D.负极(Fe钉):Fe-3e-=Fe3+
难度: 简单查看答案及解析
-
下列各装置中,在铜电极上不能产生气泡的是( )
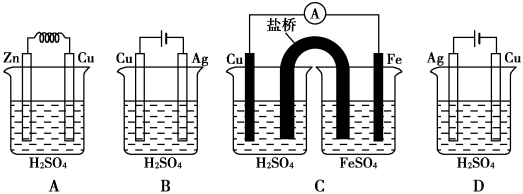
难度: 中等查看答案及解析
-
在一恒定的容器中充入2 mol X和1 mol Y发生反应:2X(g)+Y(g)
nZ(g)达到平衡后,Z的体积分数为a%;若维持容器的容积和温度不变,按起始物质的量X为0.6 mol,Y为0.3 mol,Z为1.4 mol充入容器中,达到平衡后,Z的体积分数仍为a%,则n的值为( )
A.可能为2,也可能为3 B.只能为3
C.只能为2 D.无法确定
难度: 中等查看答案及解析