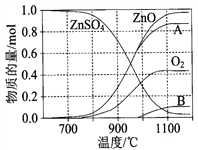
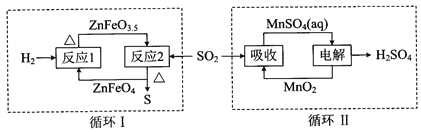
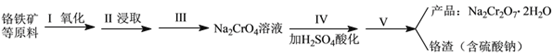-
化学与生产、生活、社会密切相关。下列有关说法错误的是
A. 使用布袋购物、以步代车等属于“低碳生活”方式
B. 研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生
C. 将废电池深埋,可以避免其中的重金属污染
D. 采用光触媒技术将汽车尾气中的NO和CO转化为无毒气体
难度: 简单查看答案及解析
-
下列表示物质结构的化学用语正确的是
A. H2O2的电子式:
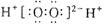 B. NaHCO3的电离:NaHCO3= Na+ + H+ + CO32-
B. NaHCO3的电离:NaHCO3= Na+ + H+ + CO32-C. 二氧化硅的分子式:SiO2 D. 质子数为8,中子数为10的氧原子:
难度: 中等查看答案及解析
-
下列说法正确的是
A. SO2溶于水,其水溶液能导电,说明SO2是电解质
B. 用广泛pH试纸测得0.10mol/LNH4Cl溶液的pH=5.2
C. 为保护地下钢管不受腐蚀,可与直流电源负极连接
D. 常温下用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3,则常温下Ksp(BaSO4)>Ksp(BaCO3)
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
B. 1.0L1mol/L的FeCl3溶液中,所含Fe3+的数目小于NA
C. 1mol OH—参与电解产生O2,转移的电子数目为2NA
D. 0.1mol KHSO4溶于水所得溶液中所含阳离子数等于0.1NA
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是
A.
= 0.1 mol/L的溶液:Na+、K+、CO32-、NO3-
B. 能使pH试纸呈红色的溶液:K+、NH4+、I-、NO3-
C. 含大量Al3+的溶液中: Na+、 HCO3-、K+、 AlO2-
D. 由水电离产生的c(H+) =10-12mol/L的溶液中:Na+、Fe2+、SO42-、ClO-
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①SiO2
Na2SiO3
H2SiO3
②
③
④BaSO4
BaCO3
BaCl2
⑤
A. ①③ B. ①④ C. ②④ D. ③⑤
难度: 中等查看答案及解析
-
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe 有关该电池的下列说法中,正确的是
A. 锂作负极,失电子,电子从正极流向负极
B. 该电池的总反应式为:2Li+FeS=Li2S+Fe
C. 该电池可用稀硫酸作为电解液
D. 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS
难度: 中等查看答案及解析
-
对于可逆反应A(s) +3B(g)
2C(g) △H>0,下列图象中符合真实变化的是
A.
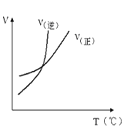 B.
B. 
C.
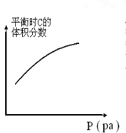 D.
D. 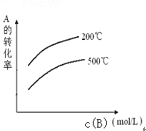
难度: 中等查看答案及解析
-
短周期元素T、X、Y、Z的原子序数依次增大,T与Z属于同一主族,X、Y、Z最高价氧化物对应的水化物两两之间都能反应,且X、Y、Z原子最外层电子数之和等于X的原子序数。则下列说法正确的是
A. 简单离子半径大小顺序:rY > rX > rT B. T与Z的最高正化合价相等
C. 室温下,单质Y不能与浓硫酸反应 D. 用电解法可制得X、Y的单质
难度: 中等查看答案及解析
-
下列装置(固定装置略去)或操作正确且能达到实验目的的是
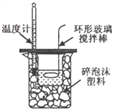
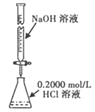
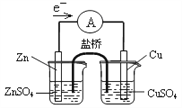
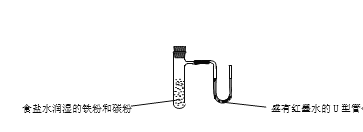
A. 中和热的测定 B. 酸碱中和滴定 C. 构成铜锌原电池 D. 模拟铁的腐蚀
难度: 中等查看答案及解析
-
对于平衡体系:a A(g)+b B(g)
c C(g)+d D(s) △H<0,下列判断中正确的是
A. 若(a+b) < (c+d),则反应一定能自发向右进行
B. 若起始时只充入A、B,且物质的量之比为a:b,则平衡时A、B的转化率之比为a:b
C. 若a+b = c+d,往含m mol气体的平衡体系中充入n mol B,则达到平衡时气体总物质的量等于(m+n)mol。
D. 若a+b = c,对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A. 用惰性电极电解等物质的量浓度的FeBr2和CuCl2混合溶液时最初发生:Cu2+ + 2Br -
Cu +Br2
B. 碳酸氢钠的水解反应:HCO
+H2O
CO32- + H3O+
C. 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3 - = BaCO3↓+NH3·H2O+H2O
D. 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2Fe2O4:3ClO- +2Fe(OH)3 = 2Fe2O42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系一定正确的是
A. 在Na2A溶液中:c (Na+)+c(H+)=c(OH-)+2c(A2-)
B. 等物质的量的NaClO、Na2CO3混合溶液中:c(HClO) + c(ClO-) = c(HCO3-) + c(H2CO3) + c(CO32-)
C. pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D. 25℃时,pH=9、浓度均为0.1 mol/L的NH3·H2O、NH4Cl混合溶液:c (NH4+)+ c (H+)>c (NH3·H2O)+ c (OH-)
难度: 中等查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g)
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器
编号
起始时各物质物质的量/mol
达平衡时体系能量的变化
X2
Y2
XY3
①
1
3
0
23.15 kJ
②
0.6
1.8
0.8
Q kJ
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ
难度: 困难查看答案及解析


 ____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。