-
化学与生产、生活密切相关。下列叙述中正确的是
A.用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似
B.石油裂化的主要目的是为了提高轻质液体燃料的产量
C.2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
D.煎炸食物的花生油和牛油都是可皂化的饱和酯类
难度: 中等查看答案及解析
-
下列说法中不正确的是
①由同一种元素组成的物质一定是单质
②阴离子一定不含金属元素,阳离子一定含金属元素
③碱性氧化物一定是金属氧化物
④酸性氧化物一定是非金属氧化物
⑤按酸分子中电离出的氢离子数目不同,可将酸分为一元酸、二元酸和多元酸
⑥无氧酸一定是非金属的氢化物
A.①③④⑤ B.①②④⑥
C.①②③⑥ D.②③⑤⑥
难度: 中等查看答案及解析
-
利用已有的实验器材,规格和数量不限,能完成相应实验的是
实验器材(省略夹持装置)
相应实验
A
烧杯、玻璃棒、分液漏斗
用溴水和CCl4除去NaBr溶液中的少量NaI
B
烧杯、玻璃棒、蒸发皿
硫酸铜溶液的结晶
C
烧杯、玻璃棒、胶头滴管、滤纸
用盐酸除去硫酸钡中的少量碳酸钡
D
烧杯、玻璃棒、胶头滴管、容量瓶
用固体氯化钠配制0.5 mol/L的溶液
难度: 中等查看答案及解析
-
某离子反应涉及H2O、ClO-、NH4+ 、H+、N2、Cl-六种微粒。其中c(NH4+ )随反应进行逐渐减小。下列判断正确的是
A.反应的还原产物是N2
B.消耗1 mol氧化剂,转移电子3 mol
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
难度: 中等查看答案及解析
-
下列反应的离子方程式中正确的是
A.向等物质的量浓度的NaOH和Na2CO3的混合液中加入一定量的稀盐酸:2OH-+CO32 -+4H+=CO2↑+2H2O
B.Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++2HCO3- +2OH-=CaCO3↓+2H2O+CO32 -
C.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3- =3Fe3++ NO↑+ 2H2O
D.向AlCl3溶液中滴加过量氨水:Al3++3NH3·H2O = Al(OH)3↓+ 3NH4+
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法不正确的是
A.28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
B.1 L 0.1 mol·L-1的NH4Cl溶液中含有Cl-数目为0.1NA
C.1 mol Na2O2固体与足量CO2反应转移电子数为1NA
D.标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2NA
难度: 困难查看答案及解析
-
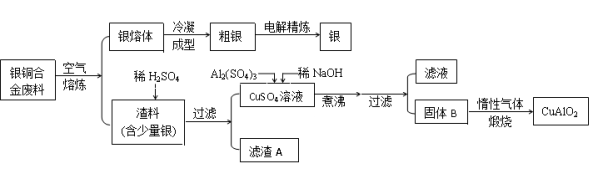
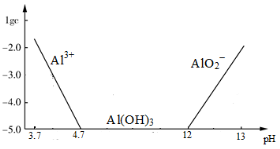
将铁铝矾[Al2Fe(SO4)4·xH2O]溶于水中,得到浅绿色溶液,有关该溶液的叙述正确的是
A. 铁铝矾有净水作用,其水溶液显中性
B. 向该溶液中加入Na2S溶液,有淡黄色沉淀
C. 用惰性电极电解该溶液时,阴极区有沉淀
D. 在空气中,蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3
难度: 中等查看答案及解析
-
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
选项 ①中物质 ②中物质 预测中的现象
A 浓盐酸 二氧化锰固体 立即产生气泡
B 浓硝酸 用砂纸打磨过的铝条 产生红棕色气体
C 氯化铝溶液 浓氢氧化钠溶液 立即产生白色沉淀
D 稀硫酸 滴有石蕊的亚硫酸钠溶液 溶液逐渐变红
难度: 中等查看答案及解析
-
科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2
Li2O2下列有关说法正确的是
A.充电时,多孔金制成的电极外接电源负极
B.放电时,Li+从负极向正极移动
C.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出
D.该电池可使用含Li+的水溶液作电解质溶液
难度: 困难查看答案及解析
-
在体积不变的400 ℃恒温密闭容器中,一定量的SO2与1 mol O2在催化剂作用下发生反应:
2SO2(g)+O2(g)
2SO3(g) ΔH =-Q kJ ∕ mol(Q﹥0)。当气体的物质的量减少0.5 mol
时反应达到平衡。下列叙述错误的是

A.增大氧气浓度,平衡正向移动,平衡常数不变
B.降低温度,正反应速率比逆反应速率减小的程度小
C.平衡时SO2气体的转化率为50%
D.该条件下反应放出0.5Q kJ的热量
难度: 困难查看答案及解析
-
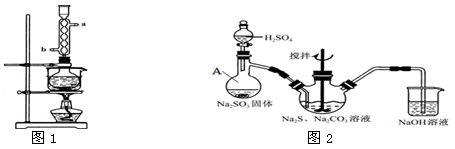
下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是

选项
发生装置中的药品
干燥和集气装置
A
氧化钙和浓氨水
图1
B
大理石和稀盐酸
图1
C
铜和稀硝酸
图2
D
电石和饱和食盐水
图2
难度: 中等查看答案及解析
-
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中,一定能大量共存的是
A.a点对应的溶液中:Na+、OH-、SO42 -、NO3-
B.b点对应的溶液中:Al3+、Fe3+,MnO4- 、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3- 、Cl-
D.d点对应的溶液中:F-、NO3- 、Fe2+、Ag+
难度: 中等查看答案及解析
-
X、Y、Z、W、Q都是短周期主族元素,其中X是短周期原子半径最大的元素,X与Y处于同一周期,Y与Z同主族且能形成两种常见的化合物,W能形成两种简单的离子,Q原子的电子总数等于其电子层数的3倍。下列说法正确的是
A.元素Q是短周期非金属性最强的元素
B.Y、Z形成的化合物中只有一种属于酸性氧化物
C.Y、Z、Q分别与W形成的化合物中,Z形成的化合物的沸点最高
D.X分别与Y、Z、W形成的化合物中可能既含离子键又含共价键
难度: 中等查看答案及解析
-
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是
A.Na2SO3溶液中存在:c (Na+)>c(SO32 -)>c (H2SO3)>c (HSO3- )
B.已知NaHSO3溶液pH<7,该溶液中:c (Na+)>c (HSO3- )>c (H2SO3)>c (SO32 -)
C.当吸收液呈酸性时:c (Na+)= c (SO32 -)+c (HSO3- )+ c (H2SO3)
D. 当吸收液呈中性时:c (Na+)=2 c (SO32 -)+c (HSO3- )
难度: 困难查看答案及解析
-
在酸性Fe(NO3)3溶液中逐渐通入H2S气体,不可能发生的离子反应是
A.3H2S+2NO3- +2H+ =2NO↑+3S↓+ 4H2O
B.3Fe3++ 3NO3- +6H2S =3NO↑+ 6S↓+3Fe2++6H2O
C.Fe3++3NO3- +5H2S+2H+=3NO↑+5S↓+Fe2++6H2O
D.Fe3++9NO3- +14H2S+ 8H+=9NO↑+14S↓+Fe2++18H2O
难度: 中等查看答案及解析
-
以0.10 mol/L的氢氧化钠溶液滴定某一元酸HA的滴定曲线如图所示。下列表述正确的是
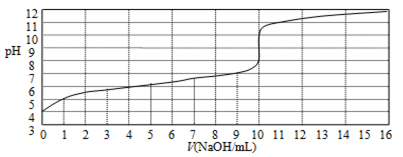
A.此实验可以选用甲基橙作指示剂
B.该酸HA的浓度约为1×10-4 mol/L
C.当NaOH体积为9 mL时,恰好完全中和反应
D.达到滴定终点时,溶液中c(Na+)>c (A-)
难度: 中等查看答案及解析
-
在体积均为1.0 L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
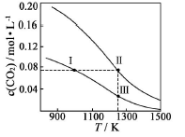
A.化学平衡常数K:K(状态I)<K(状态II)<K(状态III)
B.CO2的平衡转化率α:α(状态I)<α(状态Ⅱ)=α(状态III)
C.体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)
难度: 困难查看答案及解析
-
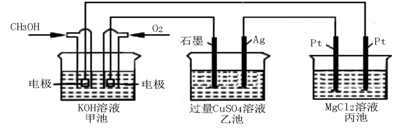
某同学组装了如图所示的电化学装置,则下列说法正确的是
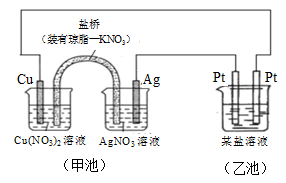
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3- 的浓度不变
C.若甲池中Ag电极质量增加5.4 g时,乙池某电极析出1.6 g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小
难度: 困难查看答案及解析
-
已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且
的值仅与温度高低有关。当n(NaOH)=6a mol时,下列有关说法不正确的是
A.改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol
B.改变温度,产物中NaCl的最小理论产量为4a mol
C.参加反应的氯气的物质的量3a mol
D.某温度下,若反应后
=6,则溶液中
=6
难度: 中等查看答案及解析
-
在含有0.06 mol Cl-、0.07 mol SO42 -及一定量Mg2+和Al3+的混合溶液中,滴入2 mol/L NaOH溶液,产生沉淀情况如图。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离)。则下列说法错误的是
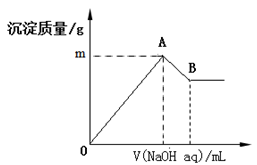
A.a的取值范围是0<a<1/15
B.图中m的取值范围5.2~5.8
C.A、B两点横坐标的数值均随x变化而变化
D.若B点横坐标数值为120 ,则a=0.04
难度: 中等查看答案及解析