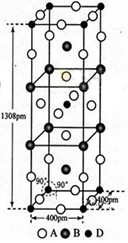
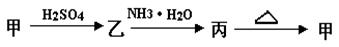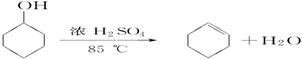-
下列各组物质中,第一种是含氧酸,第二种是强电解质,第三种是混合物的是( )。
A.水、纯碱、空气 B.HNO3、盐酸、碱石灰
C.H2SO4、NaCl、烟 D.Fe2O3、BaSO4、饱和食盐水
难度: 简单查看答案及解析
-
下列物质属于同系物的是
A.CH3CH2CH2OH与CH3OH B.
与
C.乙酸与HCOOCH3 D.CH3CH2Cl与CH3CH2CH2Br
难度: 中等查看答案及解析
-
已知2H2(g)+ O2(g)=2H2O(g) △H= ─484KJ/moL,则反应H2O(g)= H2(g)+
O2(g) 的△H为
A.─484kJ/mol B.+484kJ/mol C.─242kJ/mol D.+242kJ/mol
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
难度: 中等查看答案及解析
-
下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥配制一定浓度的溶液,一定要用到玻璃棒的是( )
A.③④⑥ B.②③⑥ C.①②⑥ D.④⑤⑥
难度: 简单查看答案及解析
-
下列物质的电子式正确的是

难度: 中等查看答案及解析
-
下列关于氯气、氯水的叙述中正确的是( )
A.氯气、液氯、氯水是同一种物质
B.新制氯水可以使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,逸出的气体是氯气
D.新制氯水放置数天后pH变大
难度: 中等查看答案及解析
-
下列关于能层与能级的说法中不正确的是()
A.原子核外电子的每一个能层最多可容纳的电子数为2n2
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数
C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D.1个原子轨道里最多只能容纳2个电子,但自旋方向相反
难度: 中等查看答案及解析
-
下列事实能说明亚硝酸是弱电解质的是:
①亚硝酸钠溶液的PH大于7 ②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L—1HNO2溶液的PH=2.1
A.①②③ B.②③④ C.①④ D.①②④
难度: 中等查看答案及解析
-
下列物质中,中心原子的杂化类型为sp3杂化的是
A.BeCl2 B.NH3 C.BF3 D.C2H4
难度: 中等查看答案及解析
-
某配合物的分子结构如图所示,其分子内不含有( )

A.离子键 B.共价键 C.配位键 D.氢键
难度: 中等查看答案及解析
-
下列各组物质气化或熔化时,所克服的微粒间的作用(力) 属同种类型的是( )
A.碘和干冰的升华 B.二氧化硅和生石灰的熔化
C.氯化钠和铁的熔化 D.氯化钠和氯化氢分别溶于水
难度: 中等查看答案及解析
-
下列各组离子能大量共存,且溶液无色透明的是( )。
A.K+、Cu2+、NO3-、SO42- B.Ag+、NO3-、Cl-、Mg2+
C.Na+、HCO3-、OH-、MnO4- D.NH4+、NO3-、SO42-、H+
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105 Pa, 44g CO2中含有的原子数为3NA
C.1 mol Cl2与足量Fe反应,转移的电子数为3NA
D.标准状况下,11.2LH2O 含有的分子数为0.5NA
难度: 中等查看答案及解析
-
下列事实可以用勒夏特列原理解释的是( )
A.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
B.使用催化剂,提高合成氨的生产效率
C.新制的氯水在光照条件下颜色变浅
D.H2、I2、HI平衡混合气体加压后颜色变深
难度: 中等查看答案及解析
-
香叶醇是合成玫瑰香油的主要原料,其结构简式如下,下列有关香叶醇的叙述正确的是
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
难度: 中等查看答案及解析
-
等电子体之间结构相似、性质也相近。以下各组粒子不能互称为等电子体的是
A.CO和N2 B.O3和SO2 C.N2H4和C2H4 D.CO2和N2O
难度: 中等查看答案及解析
-
以下各微粒中,所有原子都满足最外层为8电子结构的是
A.NCl3 B. BF3 C. PCl5 D.H3O+
难度: 中等查看答案及解析
-
美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构——Al13和Al14. 已知这类“超级原子”最外层电子数之和为40时处于相对稳定状态.下列说法中正确的是
A.Al13、Al14互为同位素
B.Al14最外层电子数之和为42,与第ⅡA族元素原子的性质相似
C.Al13超原子中Al原子间通过离子键结合
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
难度: 中等查看答案及解析
-
美国Lawrece Liermore国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法,正确的是:
A.CO2的原子晶体和分子晶体互为同分异构体
B.在一定条件下,CO2原子晶体转化为CO2分子晶体是物理变化
C.CO2的原子晶体和CO2分子晶体具有相同的物理性质和化学性质
D.在CO2的原子晶体中,每一个C原子结合4个O原子,每一个O原子跟两个C原子相结合
难度: 中等查看答案及解析
-
下列有关晶体的说法中一定正确的是( )
①原子晶体中只存在非极性共价键 ②稀有气体形成的晶体属于原子晶体③干冰晶体升华时,分子内共价键会发生断裂④金属元素和非金属元素形成的化合物一定是离子化合物
⑤分子晶体的堆积均为分子密堆积 ⑥金属晶体和离子晶体都能导电⑦离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键⑧依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体
A.①③⑦ B.只有⑦ C.②④⑤⑦ D.⑤⑧
难度: 中等查看答案及解析