-
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是
A.锂电极作电池负极,放电过程中发生还原反应
B.1 mol SOCl2发生电极反应转移的电子数为4 mol
C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2
D.组装该电池必须在无水、无氧的条件下进行
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.原子半径由大到小的顺序为:Z>Y> W
C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2
难度: 中等查看答案及解析
-
已知1—18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是
A.四种元素位于同一周期 B.氢化物的稳定性H2Y>HZ
C.离子的氧化性aW3+> bX+ D.a+3<c-2
难度: 中等查看答案及解析
-
在一定温度下,某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
难度: 中等查看答案及解析
-
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
难度: 中等查看答案及解析
-
下列说法正确的是
A.乙烯的结构简式可以表示为CH2CH2
B.苯、乙醇和乙酸都能发生取代反应
C.油脂都不能使溴的四氯化碳溶液褪色
D.液化石油气和天然气的主要成分都是甲烷
难度: 简单查看答案及解析
-
下列叙述中,不正确的是
A.只有非金属原子间才能形成共价键
B.共价化合物中不可能含有离子键
C.单质中不可能含有离子键
D.非金属单质中不一定含有共价键
难度: 简单查看答案及解析
-
下列选项中能发生反应,且甲组为取代反应,乙组为加成反应的是
甲
乙
A
苯与溴水
乙烯与水制乙醇(催化剂)
B
油脂水解(催化剂、加热)
苯与氢气(催化剂、加热)
C
淀粉水解制葡萄糖(催化剂)
乙酸和乙醇的酯化反应
(催化剂、加热)
D
乙烯与溴的四氯化碳溶液
甲烷与氯气(光照)
难度: 中等查看答案及解析
-
下列对非金属元素(除稀有气体元素外)的相关判断正确的是
①非金属元素都是主族元素
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
⑤非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
A.②⑤ B.①③⑤ C.②③④ D.①⑤
难度: 中等查看答案及解析
-
下列物质中,不能使酸性KMnO4溶液褪色的物质是
①
②乙烯③CH3COOH
④CH3CH2OH⑤CH2===CH—COOH ⑥
A.①⑤ B.①②④⑥ C.①④ D.①③⑥
难度: 中等查看答案及解析
-
将4 mol A和2 mol B放入2 L密闭容器中发生反应:2A(g)+B(g)
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,v(B)=0.075 mol/(L·s)
B.当c(A)∶c(B)∶c(C)=2∶1∶2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
难度: 中等查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

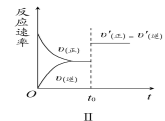

A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
难度: 中等查看答案及解析
-
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)
xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2 mol·L-1·min-1
C.反应开始前A的物质的量为3 mol
D.5 min时A的浓度为0.2 mol·L-1
难度: 中等查看答案及解析
-
对反应:A+B
AB来说,常温下按以下情况进行反应
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四种溶液反应速率的大小关系是
A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④
难度: 中等查看答案及解析
-
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
难度: 中等查看答案及解析
-
已知一定条件下断裂1 mol下列化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是
A.2HCl(g)=H2(g)+Cl2(g)的反应热ΔH<0
B.H(g)+Cl(g)=HCl(g) ΔH=+431 kJ·mol-1
C.相同条件下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相等
D.H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ
难度: 中等查看答案及解析
-
原电池电极的“正”与“负”不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是
A.由Fe、Cu和FeCl3溶液组成的原电池中,负极反应式为:Cu-2e-===Cu2+
B.由Al、Cu和稀硫酸组成的原电池中,负极反应式为:Cu-2e-===Cu2+
C.由Al、Mg和NaOH溶液组成的原电池中,负极反应:Al+4OH--3e-===AlO2-+2H2O
D.由Al、Cu和浓HNO3溶液组成的原电池中,负极反应式为:Al-3e-===Al3+
难度: 中等查看答案及解析
-
在下列反应中,生成物的能量总和高于反应物的能量总和的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) 放热反应
B.2CO(g)+O2(g)=2CO2(g) 放热反应
C.CaCO3(s)=CaO(s)+CO2(g) 吸热反应
D.H+(aq)+OH-(aq)=H2O(l) 放热反应
难度: 中等查看答案及解析
-
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为
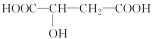 。下列相关说法不正确的是
。下列相关说法不正确的是A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下)
D.1 mol苹果酸与Na2CO3溶液反应一定消耗2 mol Na2CO3
难度: 中等查看答案及解析
-
H2O(g)―→H2O(l)是一个放热过程,但不是化学反应,Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是
A.该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变
B.上述热化学方程式中的ΔH的值与反应物的用量无关
C.该反应的化学能可以转化为电能
D.反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析