-
以下属于新能源的主要包括( )
①核能 ②柴草 ③焦炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气
A. ②③⑥⑦ B. ①④⑤ C. ③⑥⑦⑧ D. ①②④
难度: 简单查看答案及解析
-
下列物质放入水中,会显著放热的是( )
A. 生石灰 B. 蔗糖 C. 酒精 D. 食盐
难度: 简单查看答案及解析
-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图,下列叙述正确的是( )
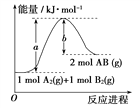
A. 每生成2分子AB吸收b kJ热量
B. 该反应中反应物的总能量高于生成物的总能量
C. 该反应热ΔH=+(a-b) kJ·mol-1
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
难度: 简单查看答案及解析
-
对于反应3A(g)+B(g)
2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A. v(A)=0.6mol/(L·min) B. v(B)=0.8 mol/(L·min)
C. v(C)=0.7mol/(L·min) D. v(D)=1.0mol/(L·min)
难度: 简单查看答案及解析
-
实验室测得4molSO2发生反应2SO2(g)+O2(g)
2SO3(g) △H=-197kJ·mol-1,当放出314.3kJ热量时,SO2的转化率最接近于( )
A. 40% B. 50% C. 80% D. 90%
难度: 中等查看答案及解析
-
实验测得101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4完全燃烧生成液态水和CO2气体,放出890.3kJ的热量。下列热化学方程式书写正确的是( )
A. 2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
D. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3kJ·mol-1
难度: 简单查看答案及解析
-
一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g)
4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
①混合气体的平均摩尔质量不再变化
②v(A)∶v(B)∶v(C)=1∶3∶4
③A、B、C的浓度不再变化
④C的体积分数不再变化
⑤A、B、C的分子数之比为1∶3∶4
⑥混合气体的密度不再变化
A. ②③④⑤⑥ B. ③④
C. ②③④ D. ①③⑤⑥
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是( )
A. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B. 合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率
C. 过氧化氢分解加催化剂二氧化锰,使单位时间内产生的氧气的量增多
D. 久置的氯水的pH变小
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
①将AgCl固体放入水中不能导电,所以AgCl是非电解质
②氨溶于水得到的溶液氨水能导电,所以氨水是电解质
③固态的共价化合物不导电,熔融状态的共价化合物可以导电
④固态的离子化合物不导电,熔融状态的离子化合物也不导电
⑤强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
A. ⑤ B. ①④⑤
C. ①②③④ D. ①②③④⑤
难度: 简单查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH- △H>0,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c (H+)增大,Kw不变
B. 向水中加入氨水,平衡逆向移动,c (OH-)降低
C. 向水中加入金属钠,平衡逆向移动,c (H+)减小
D. 将水加热,Kw增大,pH不变
难度: 简单查看答案及解析
-
常温下,下列溶液中各组离子一定能大量共存的是( )
A. 使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、Fe2+
B. 由水电离产生的 c(H+)=10-12 mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
C. 含有 0.1 mol·L-1S2-的溶液:Na+、Fe3+、NO3-、Cl-
D. Kw/c(H+)=0.1 mol·L-1的溶液:Na+、K+、SO32-、NO3-
难度: 简单查看答案及解析
-
可逆反应mA(s)+nB(g)
eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )

A. 达到平衡后,若使用催化剂,C的体积分数将增大
B. 当平衡后,若温度升高,化学平衡向逆反应方向移动
C. 化学方程式中,n>e+f
D. 达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
难度: 中等查看答案及解析
-
下列有关说法不正确的是( )
A. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
B. 反应CaCO3(s)=CaO(s)+CO2(g)在室温下不能自发进行,说明该反应ΔH<0
C. 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0,ΔS>0
D. 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
难度: 中等查看答案及解析
-
25 ℃时,将pH=2和pH=5的硫酸溶液等体积混合后,溶液的pH为( )
A. 2.3 B. 4.7 C. 3.5 D. 以上答案都不正确
难度: 中等查看答案及解析
-
根据键能估算反应CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热ΔH为( )
化学键
C—H
C—F
H—F
F—F
键能/(kJ·mol-1)
414
489
565
155
A. –1940 kJ·mol-1 B. 1940 kJ·mol-1
C. –485 kJ·mol-1 D. 485 kJ·mol-1
难度: 中等查看答案及解析
-
25 ℃时,下列四种溶液中,由水电离生成的氢离子浓度之比是( )
①1 mol·L-1的盐酸 ②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液 ④1 mol·L-1的NaOH溶液
A. 1∶10∶100∶1 B. 1∶10-1∶10-12∶10-14
C. 14∶13∶12∶14 D. 14∶13∶2∶1
难度: 中等查看答案及解析
-
已知中和热的数值是57.3kJ·mol-1。下列物质反应时产生热量为57.3kJ的是( )
A. 稀盐酸和稀NaOH溶液
B. 1.0 mol·L-1稀盐酸和1.0 mol·L-1NaOH溶液
C. 500 mL 2.0 mol·L-1稀盐酸和500 mL 2.0 mol·L-1 NaOH溶液
D. 500 mL 2.0 mol·L-1H2SO4溶液和500 mL 2.0 mol·L-1Ba(OH)2溶液
难度: 简单查看答案及解析
-
某温度下,密闭容器中发生反应 a X (g)
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
A. 可逆反应的化学计量数:a>b+c B. 压缩容器的容积时,υ正增大,υ逆减小
C. 达到新平衡时,物质X的转化率减小 D. 达到新平衡时,混合物中Z的质量分数增大
难度: 困难查看答案及解析
-
某温度下在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)
CH3OCH3(g)+H2O(g),下列说法正确的是( )
容器
编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
I
387
0.20
0.080
0.080
Ⅱ
387
0.40
Ⅲ
207
0.20
0.090
0.090
A. 该反应的正向为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C. 容器I中反应达到平衡所需时间比容器Ⅲ中的长
D. 若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
难度: 中等查看答案及解析
-
根据相应的图像,判断下列相关说法正确的是( )

aX(g)+bY(g)
cZ(g) I2(s)+aG(g)
bR(g)
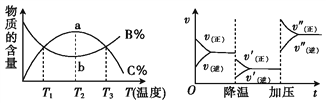
aA+bB
cC A+2B
2C+3D
A. t1时改变某一条件,如图所示,则改变的条件一定是加入催化剂
B. 反应达到平衡时,外界条件对平衡的影响如图所示,则该反应为放热反应
C. 从加反应物开始,物质的百分含量与温度的关系如图,则该反应为吸热反应
D. 反应速率和反应条件的变化如图所示,则该反应为放热反应,若A、B、C是气体,则D为固体或液体
难度: 简单查看答案及解析
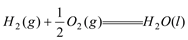 △H=-285.8kJ/mol
△H=-285.8kJ/mol △H=-241.8kJ/mol
△H=-241.8kJ/mol