-
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O⇌HCOO-+H3O+
B.CO2+H2O⇌HCO3-+H+
C.CO32-+H2O⇌HCO3-+OH-
D.HS-+H2O⇌S2-+H3O+难度: 中等查看答案及解析
-
下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解难度: 中等查看答案及解析
-
温度不变时,向饱和BaSO4溶液中加水,下列叙述正确的是( )
A.BaSO4的溶解度不变,Ksp不变
B.BaSO4的溶解度减小,Ksp增大
C.BaSO4的溶解度不变,Ksp增大
D.BaSO4的溶解度增大,Ksp不变难度: 中等查看答案及解析
-
反应A(g)+3B(g)⇌2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
A.υ(D)=0.4 mol/
B.υ(C)=0.5 mol/
C.υ(B)=0.6 mol/
D.υ(A)=0.15 mol/难度: 中等查看答案及解析
-
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是( )
A.MgO
B.MgCO3
C.NaOH
D.Mg(OH)2难度: 中等查看答案及解析
-
区分强电解质和弱电解质的依据是( )
A.溶解度的大小
B.属于离子化合物还是共价化合物
C.是否存在电离平衡
D.导电性的强弱难度: 中等查看答案及解析
-
升高温度时,化学反应速率加快,主要是由于( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的难度: 中等查看答案及解析
-
可逆反应达到平衡的根本原因是( )
A.反应混合物中各组分的浓度相等
B.正逆反应都还在继续进行
C.正逆反应的速率均为零
D.正逆反应的速率相等难度: 中等查看答案及解析
-
某温度下,反应SO2(g)+
O2(g)⇌SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)⇌2SO2(g)+O2(g)的平衡常数K2的值为( )
A.2500
B.100
C.4×10-4
D.2×10-2难度: 中等查看答案及解析
-
下列化合物属于弱电解质的是( )
A.HClO4
B.Ba(OH)2
C.CO2
D.HF难度: 中等查看答案及解析
-
0.05mol/L的Ba(OH)2溶液,pH为( )
A.12.7
B.12.0
C.13.0
D.13.7难度: 中等查看答案及解析
-
下列离子在pH=1的溶液中能够大量共存的是( )
A.F-、Na+、K+、Cl-
B.Ca2+、K+、Cl-、NO3-
C.Fe2+、NO3-、K+、Cl-
D.Al3+、Ag+、K+、Cl-难度: 中等查看答案及解析
-
NH4Cl溶液中,下列叙述错误的是( )
A.c(NH4+)>c(Cl-)>c(OH-)>c( H+)
B.c(Cl-)>c(NH4+)>c( H+)>c(OH-)
C.c(NH4+)+c( H+)=c(Cl-)+c(OH-)
D.c(NH4+)+c=c(Cl-)难度: 中等查看答案及解析
-
下列说法正确的是( )
A.难溶电解质的溶度积越小,溶解度越大
B.可以通过沉淀反应使杂质离子完全沉淀
C.难溶电解质的溶解平衡是一种动态平衡
D.一定浓度的氨水溶液可以溶解Mg(OH)2难度: 中等查看答案及解析
-
关于强弱电解质及非电解质的组合完全正确的是( )
A B C D 强电解质 NaCl H2SO4 CaCO3 HNO3 弱电解质 HF BaSO4 HClO CH3COOH 非电解质 Cl2 CS2 C2H5OH H2
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
难溶电解质AB2饱和溶液中,c(A2+)=x mol•L-1,c(B-)=y mol•L-1,则Ksp(AB2)值为( )
A.
B.xy
C.xy2
D.4xy2难度: 中等查看答案及解析
-
在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀( )
A.溶解
B.增多
C.不变
D.无法判断难度: 中等查看答案及解析
-
当氢氧化钙固体在水中达到溶解平衡Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)时,为使Ca (OH)2 固体的量减少,须加入少量的( )
A.Na N03
B.NaOH
C.CaS04
D.H2S04难度: 中等查看答案及解析
-
能表示人体大量喝水时,胃液的pH变化的图象是( )
A.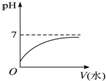
B.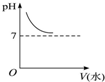
C.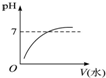
D.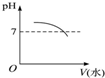
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl-
B.澄清石灰水与少量碳酸钠溶液混合:Ca (OH)2+CO32-═CaCO3↓+2OH-
C.碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O
D.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O难度: 中等查看答案及解析