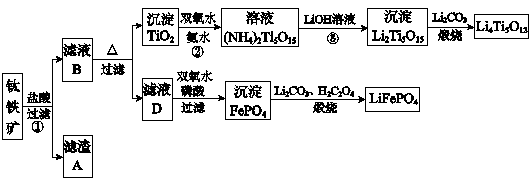
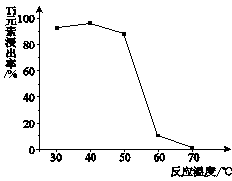
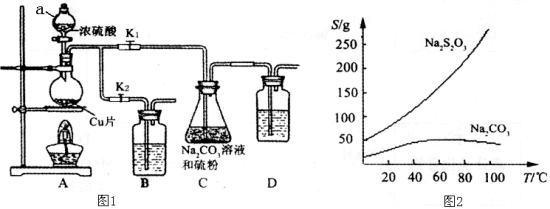
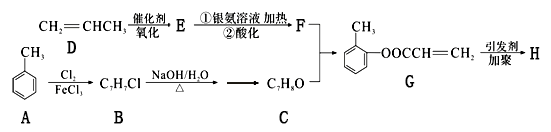
-
W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构, W的最高氧化物的水化物可与其最简单的气态氢化物反应生成易溶于水的盐,X的氧化物具有两性,Y的最高正价与最低负价的代数和为0,下列说法正确的是( )
A. 离子半径:W> Z > X B. 单质熔点:W>Z
C. 最高正价:W> X >Y >Z D. W、X、Z最高价氧化物对应的水化物相互之间能发生反应
难度: 中等查看答案及解析
-
化学与生产、生活、科技等密切相关,下列说法正确的是
A. 由石油制取乙烯、丙烯等化工原料不涉及化学变化
B. 向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应
C. 鲜花运输途中需喷洒高锰酸钾稀溶液,主要是为鲜花补充钾肥
D. 牙膏中添加的Na3PO3F、NaF提供的氟离子浓度相等时,它们防治龋齿的作用相同
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 将lmolCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-) =2[NA—N(C12)](N表示粒子数)
B. 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2 NA
C. 1mol葡萄糖与足量的钠反应能产生2.5mol H2
D. 相同质量的Na2O2和Na2S固体具有相同的阴阳离子数和质子数
难度: 中等查看答案及解析
-
有机物X可作为合成青蒿素的一种基本原料,已知X的结构如下,下列有关X的说法正确的是
( )
A. X为烃的含氧衍生物
B. X最多可以和3mol H2发生加成反应
C. X只能发生取代反应和加成反应
D. X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同
难度: 中等查看答案及解析
-
构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”。当电解质中某离子的浓度越大时其氧化性或还原性越强。如图,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K2,断开K1,发现电流计指针发生偏转。下列说法不正确的是
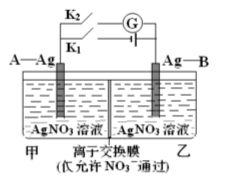
A. 一段时间后电流计指针将归零,此时可视为反应不再进行
B. 当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升
C. 当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加
D. 实验开始先闭合K2,断开K1,此时NO3-向B电极移动
难度: 困难查看答案及解析
-
下列图示与对应的叙述不相符的是( )

A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
难度: 困难查看答案及解析
-
常温常压下,丙二酸(HOOCCH2COOH)的电离常数为Ka1=1.4×10-3,Ka1=2.0×10-6。向10mL某浓度的丙二酸溶液中滴加0.2mol • L-1NaOH溶液,在滴加过程中下列有关说法不正确的是
A. 在中和反应未完成前随着NaOH溶液的滴加,-OOCCH2COO-的物质的量浓度逐渐升高
B. 若滴入的NaOH溶液的体积为10ml时溶液温度最高,则丙二酸的物质的量浓度= 0.1mol·L-1
C. 在丙二酸未完全中和前,随着NaOH的滴加,水的电离程度逐渐增大
D. 若忽略丙二酸氢根离子的电离和水解,丙二酸根离子的水解常数约为7.14×10-12
难度: 困难查看答案及解析