-
二氧化硫、氯气、氧化亚砜均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)
2SOCl2(g)
(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据Ⅰ(反应达到平衡时的溫度与起始温度相同,P0为初始压强)。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| Ⅰ | P | 6.0 P0 | 6.7 P0 | 6.l P0 | 5.4 P0 | 5.0 P0 | 5.0 P0 |
| II | P | 6.0 P0 | 7.0 P0 | 5.3 P0 | 5.O P0 | 5.0 P0 | 5.0 P0 |
| | | | | | | |
谪回答下列问题:
①该反应的△H_________(填“>”“ <”或“=”)0。
②若只改变某一条件,其他条件相同时.测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是_________ 。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。
①A点的数值为______________。(己知:lg4=0.6)
②当升高到某一温度吋.反应重新达到平衡,A点可能变化为___________点。

(3)己知反应 S4(g)+4Cl2(g) = 4SCl2(g)的△H=-4kJ·mol-1,1molS4(g)、lmolSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为__________kJ。
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2 Ka2=1.02×10-7。
①SOCl2溶于水中可形成两种酸,其中HCl的物质的量浓度为10mol/L时,H2SO3的物质的量浓
度_______(大于、小于、等于)1.25mo1/L。
②向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=amL时,溶液中离子浓度有如下关系:c (Na+) =2c (SO32-) +c (HSO3-) ;当V=bmL时,溶液中离子浓度有如下关系:c (Na+) =c(SO32-) +c (HSO3-) +c(H2SO3);则 a________b(大于、小于、等于)。
-
硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:
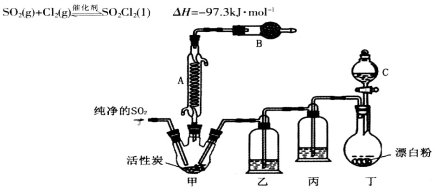
回答下列问题:
(1)仪器A的名称为______,甲中活性炭的作用是______,B中加入的药品是______。实验时从仪器C中放出溶液的操作方法是________。
(2)装置丁中发生反应的离子方程式为___________。用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,下图中可选用的发生装置是________(填写字母)。
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________,分离产物的方法是_________。
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_______。为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可)_______。
-
硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,已知:SO2(g)+Cl2(g) SO2Cl2(l) △H=﹣97.3kJ/mol,实验室合成反应和实验装置如图所示:
SO2Cl2(l) △H=﹣97.3kJ/mol,实验室合成反应和实验装置如图所示:
回答下列问题:
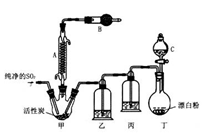
(1)仪器A的名称为_________,活性炭的作用是 B中加入的药品是_________。实验时从仪器C中放出溶液的操作方法是_________ 。
(2)装置丁中发生反应的离子方程式为_________ __。用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,下图中可选用的发生装置是________(填写字母)。

(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________,分离产物的方法是_________。
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_____ 。为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可)_ 。
-
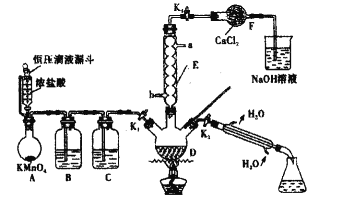
氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:
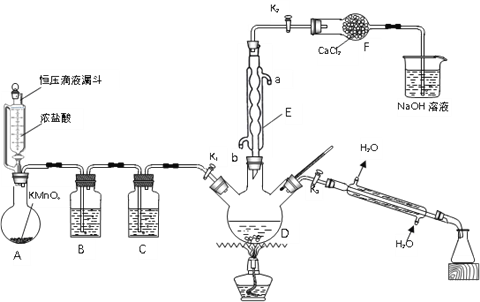
回答下列问题:
(1)仪器E的名称是______;其作用是______;其进水口为______(填“a”或“b”)。
(2)装置B中的溶液为______;装置F的作用是______。
(3)用恒压滴液漏斗代替分液漏斗的优点是______。
(4)装置A中反应的离子方程式为______。
(5)反应结束后,关闭K1和K2,打开K3,加热三颈烧瓶,分馏出氯化苄,应选择温度范围为______℃。
| 物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
| 甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
| 氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
| 二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
| 三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
(6)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL 4 mol•L-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为______%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是______。
-
氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:
回答下列问题:
(1)仪器E的名称是______;其作用是______;其进水口为______(填“a”或“b”)。
(2)装置B中的溶液为______;装置F的作用是______。
(3)用恒压滴液漏斗代替分液漏斗的优点是______。
(4)装置A中反应的离子方程式为______。
(5)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL4mol•L-1NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40%HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为______%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是______。
-
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。
试回答下列问题:
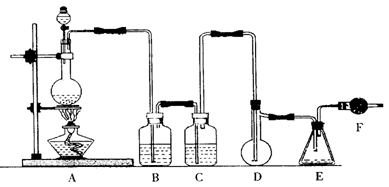
(1)装置A中发生反应的化学方程式为________。
(2)装置B、C应盛放的药品分别是、________。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是________。
(4)实验时,D装置需加热至50—59℃.最好采用的措施是________ 、如何防止E中液体挥发?________。
(5)F装置中干燥管内所盛物质是,作用是________。
(6)由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为________。
-
硫酰氯(SO2Cl2)常作氯化剂或氯璜化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
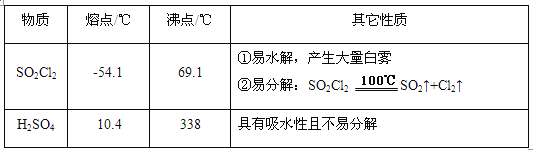
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g)  SO2Cl2(l) △H=—97.3 kJ·mol-1反应装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l) △H=—97.3 kJ·mol-1反应装置如图所示(夹持仪器已省略),请回答有关问题:
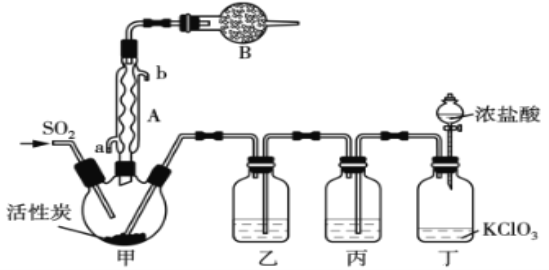
(1)仪器A的名称为___________________;
(2)仪器B的作用是_____________________;
(3)装置丙中盛放的试剂为____________,在实验室用氢氧化钠吸收多余硫酰氯的离子反应方程式为___________________;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气体
②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温
④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:
2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的实验操作名称为__________________,
②请设计实验方案检验氯磺酸分解制取硫酰氯产品中混有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、紫色石蕊溶液)__________________________。
-
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是______(填元素符号).当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为______L.
8SO2+2Fe2O3,该反应中被氧化的元素是______(填元素符号).当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为______L.
(2)实验室中用如图1所示的装置测定SO2催化氧化为SO3,的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
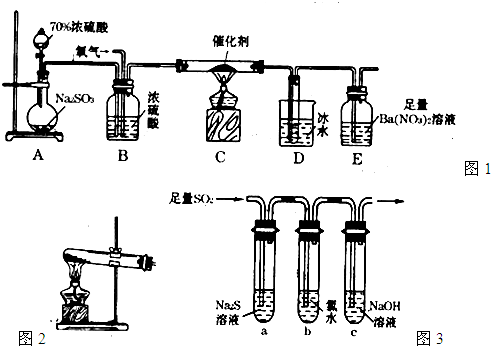
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______.
②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式______△2KCl+O2↑
-
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式 。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
-
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
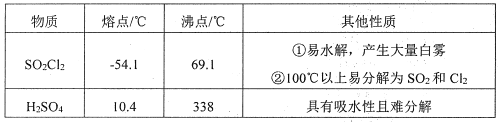
实验室用干燥而纯浄的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3 kJ· mol-1
SO2Cl2(l) △H=-97.3 kJ· mol-1
反应装置如图所示(夹持仪器已省略),请回答有关问题:
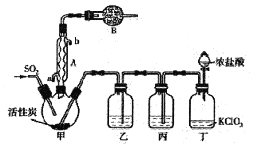
(1)仪器B的名称为________;
(2)仪器A的作用是_______;
(3)装置乙中盛放的试剂为______,在实验室用氢氧化钠溶液吸收多余硫酰氯的离子反应方程式为______;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______(填序号);
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①分解产物中分离出硫酰氯的实验操作名称为____。
②某同学为检验硫酰氯产品中是否混有硫酸设计实验如下:取少量产品溶于水,加入盐酸酸化的氯化钡溶液,振荡,观察到有白色沉淀生成,则认为产品中含有硫酸。该同学的结论是否正确,请说明理由____。
2SOCl2(g)















