-
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
 ,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为________L。
,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为________L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16. 8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
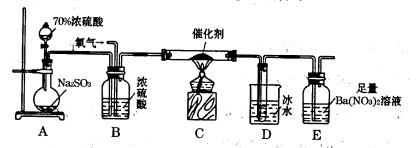
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是________。
②实验过程中,需要通入氧气。试写出一个用右图所示装置制取氧气的化学方程式________ 。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。
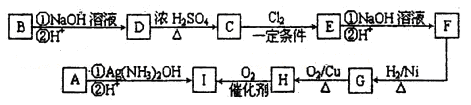
(3)某学习小组设计用如右图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:

方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为________。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= ________(用含硫微粒浓度的代数式表示)。)】
-
I、二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。

(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
 ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。
(2)一化学研究性学习小组设计用如下装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaC!:溶液,产生白色沉淀上述方案合理的是方案______(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子反应方程式为____________________。
③当通入二氧化硫至试管c中溶液显中性时,溶液中c(Na+)=________________(用含硫元素微粒浓度的代数式表示)。
Ⅱ、另一化学研究性学习小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:
电解时,粗铜应与电源的______极相连。阴极上的电极反应式为____________。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该反应的离子方程式:
____________________________________________________________。
-
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是______(填元素符号).当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为______L.
8SO2+2Fe2O3,该反应中被氧化的元素是______(填元素符号).当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为______L.
(2)实验室中用如图1所示的装置测定SO2催化氧化为SO3,的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______.
②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式______△2KCl+O2↑
-
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式 。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
-
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。 (1)T业上用黄铁矿(FeS2)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率(已知SO3。熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)。
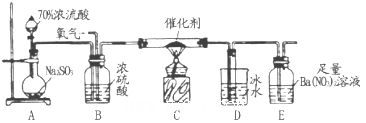
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______。
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
③实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
(3)某兴趣小组欲在绿色环保的条件下探究SO2的性质,设计如下图实验装置。
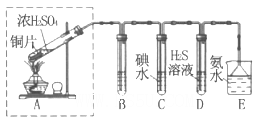
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为_______;
C中反应的离子方程式为______ ;D中的实验现象为______ ;E装置的作用是______。
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。探究二氧化硫的制取和性质都有着非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2:

该反应中被氧化的元素是__________(填元素符号)。当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为________L。
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是_______(填写字母)。
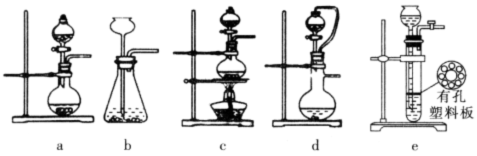
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠_______g(保留一位小数)。
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质。
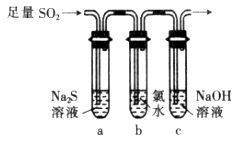
①能说明二氧化硫具有氧化性的实验现象为___________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为______________。
-
(15分)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
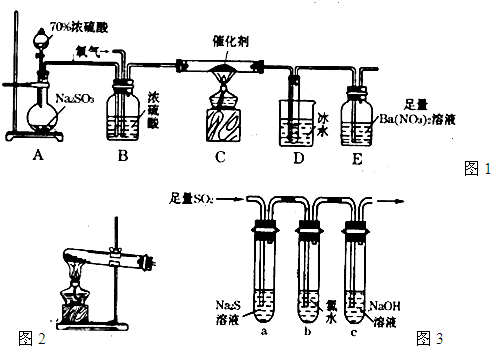
(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= (用含硫微粒浓度的代数式表示)。
-
SO2是高中化学重点学习的三大气体之一,是常见的大气污染物之一,同时也是重要的工业原料,探究其制备方法和性质具有非常重要的意义,请回答下列问题。
Ⅰ.某研究小组将纯净的SO2气体通入0.5 mol·L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-;假设二:溶液中溶解的O2
(1)验证假设一:
①请在下表空白处填写相关实验现象
| 实 验 步 骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的10 mL 0.5 mol/L BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体。 | ______ | 假设一 成立 |
| 实验2:在盛有不含O2的10 mL 0.5mol/L Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体。 | ______ |
②设计实验一的目的是________________。
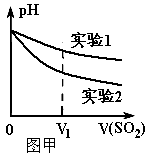
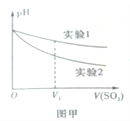
(2)为深入研究该反应,该小组还测得上述两个实验中溶 液的pH随通入SO2体积的变化曲线如图甲。实验2中溶液pH小于实验1的原因是(用离子方程式表示)___________________。
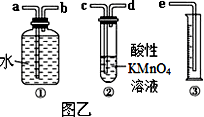
Ⅱ.我国规定空气中SO2含量不得超过0.02 mg/L。某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
(1)若原料气从左向右流,上述装置连接的顺序是:原料气→_______________(用字母和箭头表示)。当装置②中出现______现象时,立即停止通气。
(2)你认为以下试剂中,可以用来代替试管中的酸性高锰酸钾溶液的是________。
A.NaOH溶液 B.溴水
C.氨水 D.BaCl2溶液
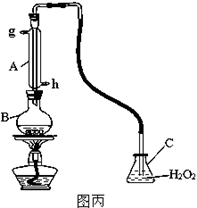
Ⅲ.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对含量定性测定。
(1)B中加入250.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0600mol/LNaOH标准溶液进行滴定,滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为__________g/L。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________。
-
SO2是高中化学重点学习大三大气体之一,是常见的大气污染物之一,同时有是重要的工业原料,探究其制备方法和性质具有非常重要的意义,请回答下列问题。
Ⅰ.某研究小组将纯净的SO2气体通入0.5mol/L的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
①请在下表空白处填写相关实验现象。
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ | 假设一成立 |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ |
②设计实验1的目的是_________。
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图甲所示。实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
Ⅱ.我国规定空气中SO2含量不得超过0.02mg/L。某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

(1)若原料气从左向右流时,上述装置连接的顺序是:原料气→______ (用字母和箭头表示)。当装置②中出现_______现象时,立即停止通气。
(2)你认为下列试剂中,可以用来代替试管中的酸性KMnO4溶液的是________。(填字母代号)
A.NaOH溶液 B.溴水 C.氨水 D.BaCl2溶液
Ⅲ.中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行定性测定。
(1)B中加入250.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0900mol/L NaOH标准溶液进行滴定,滴定终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g/L。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____。
-
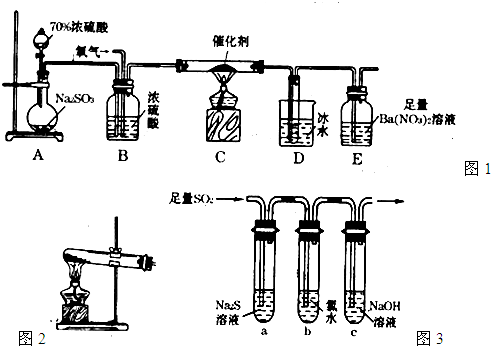
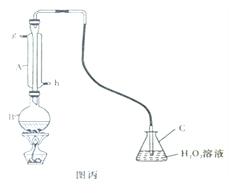
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。
硫铁矿




 Na2S2O3·5H2O
Na2S2O3·5H2O
已知:Ⅰ.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
Ⅱ.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是_______________________________。
(2)吸收塔中的原料B可以选用________(填字母序号)。
a.NaCl溶液 b.Na2CO3溶液 c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。
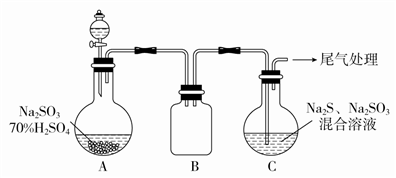
①使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是____________________。装置B的作用是______________________。
②C中制备Na2S2O3发生的连续反应的化学方程式有Na2S+H2O+SO2===Na2SO3+H2S、2H2S+SO2===3S↓+2H2O (或)2H2S+H2SO3===3S↓+3H2O和___________________________________。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为__________。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。






 ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。














 Na2S2O3·5H2O
Na2S2O3·5H2O