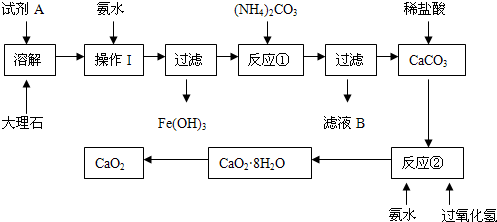
-
下列说法正确的是
A.所谓低碳经济,是指在可持续发展理念指导下,尽可能地减少光化学污染气体的排放
B.汽油、柴油和植物油都是碳氢化合物
C.只由一种元素组成的物质,一定是纯净物
D.化学反应的实质就是旧化学键的断裂、新化学键形成过程
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数的值,下列说法正确的是
A.在标准状况下,11.2L NH3含有5NA个质子
B.Na2O2与CO2反应产生1molO2时,转移电子数为4NA
C.SO2、CO2、NO、NO2都是大气污染物,实验中都必须进行尾气吸收
D.明矾和漂白粉常用于自来水的净化或杀菌消毒,两者的作用原理相同
难度: 中等查看答案及解析
-
下列比较中,正确的是
A.CH4与SiH4的稳定性:CH4>SiH4
B.HClO与H2SO4的酸性:HClO >H2SO4
C.1molHCl(g)的能量比1molH2(g)和1molCl2(g)的能量和高
D.Cl与S的原子半径:Cl >S
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是
A.碘化亚铁溶液中通入少量氯气:Cl2+2Fe2+=2Fe3++2Cl—
B.向1mol/L 0.1L的明矾溶液中加入0.5mol/L 0.2L的Ba(OH)2溶液:
2Al3++3SO42—+ 3Ba2++6OH—=2Al(OH)3↓+3BaSO4↓
C.将蛋壳浸泡到醋酸中:CO32—+2CH3COOH=2CH3COO—+ CO2↑+H2O
D.将过氧化钠与水反应:2O22—+2H2O=O2+4OH—
难度: 中等查看答案及解析
-
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPbO2被还原
B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后, c(Na2SO4)不变,且溶液中有晶体析出
D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O
难度: 中等查看答案及解析
-
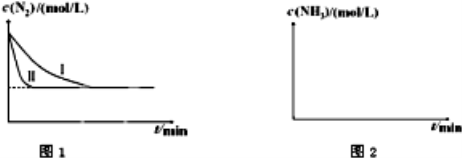
向盛有一定量氢氧化钠溶液的烧杯中通入标准状况下448mL氮气和二氧化碳的混合气体后得到溶液A,在溶液A中逐滴加入0.1mol/L的稀盐酸至过量,并将溶液加热,产生的二氧化碳气体的物质的量与加入稀盐酸的体积的关系如图所示
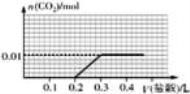
(忽略二氧化碳的溶解和氯化氢的挥发).下列说法正确的是
A.原混合气体中氮气与二氧化碳体积之比为1:4
B.在逐滴加入稀盐酸产生二氧化碳之前,发生的离子反应为CO32-+H+═HCO3-
C.溶液A中含有0.01molNaOH和0.01molNa2CO3
D.当加入0.1L稀盐酸时,此时溶液中离子浓度大小关系为
c(Na+)>c(Cl-)=c(CO32-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列实验操作不能达到预期的目的的是
实验目的
操作
A
证明CH2=CHCH2OH中含有碳碳双键
滴入溴水
B
欲证明浓硫酸有脱水性和强氧化性
将浓硫酸滴到蔗糖上
C
证明FeCl2溶液中含有Fe2+
加入酸性KMnO4溶液
D
比较确定铜和镁的金属活动性强弱
用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液
难度: 中等查看答案及解析
-
对盆栽鲜花施用S-诱抗素制剂,可以保持鲜花盛开。S-诱抗素的分子结构如图,则1mol该物质与足量的NaOH溶液反应时最多可消耗NaOH的物质的量为
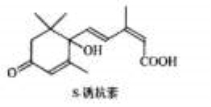
A.1mol B. 2mol C. 3mol D. 4mol
难度: 简单查看答案及解析