-
向盛有一定量氢氧化钠溶液的烧杯中通入标准状况下448mL氮气和二氧化碳的混合气体后得到溶液A,在溶液A中逐滴加入0.1 mol/L的稀盐酸至过量,并将溶液加热,产生的二氧化碳气体的物质的量与加入稀盐酸的体积的关系如图所示(忽略二氧化碳的溶解和氯化氢的挥发)。下列说法正确的是( )
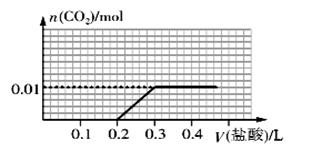
A.原混合气体中氮气与二氧化碳体积之比为1∶4
B.在逐滴加入稀盐酸产生二氧化碳之前,发生的离子反应为CO32-+H-==HCO3-
C.溶 液 A 中 含 有 0 . 01 mol NaOH 和0.01 mol Na2CO3
D.当加入0.1 L稀盐酸时,此时溶液中离子浓度大小关系为c(Na+)>c(Cl-)=c(CO32-)>c(OH-)>c(H+)
-
向盛有一定量氢氧化钠溶液的烧杯中通入标准状况下448mL氮气和二氧化碳的混合气体后得到溶液A,在溶液A中逐滴加入0.1mol/L的稀盐酸至过量,并将溶液加热,产生的二氧化碳气体的物质的量与加入稀盐酸的体积的关系如图所示
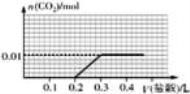
(忽略二氧化碳的溶解和氯化氢的挥发).下列说法正确的是
A.原混合气体中氮气与二氧化碳体积之比为1:4
B.在逐滴加入稀盐酸产生二氧化碳之前,发生的离子反应为CO32-+H+═HCO3-
C.溶液A中含有0.01molNaOH和0.01molNa2CO3
D.当加入0.1L稀盐酸时,此时溶液中离子浓度大小关系为
c(Na+)>c(Cl-)=c(CO32-)>c(OH-)>c(H+)
-
标准状况下,往100mL 0.1mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是( )
A.0.224L B.0.336L C.0.448L D.0.672L
-
标准状况下,往100mL 0.1mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是
A.0.224L B.0.336L C.0.448L D.0.672L
-
将51.2g铜恰好完全溶于一定量的硝酸溶液中,得到硝酸铜溶液,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共17.92L(标准状况),在这些气体中通入VL(标准状况)的氧气后用一定量的氢氧化钠溶液吸收,结果剩余2.24L(标准状况)气体。则通入氧气的体积V为
A.7.28L B.8.96L C.11.20L D.16.8L
-
某溶液中含K+、Al3+、NH4+、SO42-。取500mL该溶液加入过量的氢氧化钡溶液,经过滤、洗涤、干燥,称重得到9.32g固体1,并收集到224mL(标准状况)气体。在滤液中通入过量的CO2, 经过滤、洗涤、灼烧,称重得到0.51g固体2。原溶液中K+的浓度为
A.0.08mol/L B.0.04mol/L
C.0.02mol/L D.0.01mol/L
-
在标准状况下,由O2和Cl2组成的混合物气体共500ml,向其中通入H2,在一定条件下,使其恰好完全燃烧,用水吸收所得到产物后制得250ml溶液。从中取出25ml溶液与20ml 0.125mol·L-1NaoH溶液反应恰好中和,则与混合气体反应的H2的体积为
A.280ml B.440ml C.500rnl D.720ml
-
将一定量的铜粉加入到100 mL某浓度的稀硝酸中充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体448 mL(标准状况),然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2 g,则(m1-m2)为
A. 5.76 B. 2.88 C. 1.92 D. 0.28
-
将一定量的铜粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩有m1g 铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g ,则(m1-m2)为
A.5.76 B.2.88 C.1.92 D.0
-
将一定量的铜粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g,则(m1-m2)为
A.5.76 B.2.88 C.1.92 D.0

