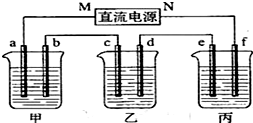
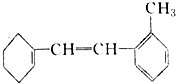-
下列中草药煎制步骤中,属于过滤操作的是
A.冷水浸泡
B.加热煎制
C.箅渣取液
D.灌装保存
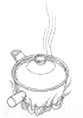
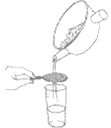

难度: 简单查看答案及解析
-
下列各组中的物质均能发生加成反应的是
A.乙烯和乙醇 B.苯和氯乙烯 C.乙酸和溴乙烷 D.丙烯和丙烷
难度: 中等查看答案及解析
-
轴烯是一类独特的星形环烃,三元轴烯(
)与苯
A.均为芳香烃 B.互为同素异形体
C.互为同系物 D.互为同分异构体
难度: 中等查看答案及解析
-
烷烃(
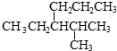 )的命名正确的是
)的命名正确的是A.4-甲基-3-丙基戊烷
B.3-异丙基己烷
C.2-甲基-3-丙基戊烷
D.2-甲基-3-乙基己烷
难度: 中等查看答案及解析
-
合成导电高分子化合物PPV的反应为:
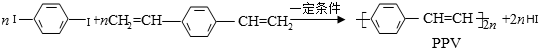
下列说法正确的是( )
A.PPV是聚苯乙炔
B.该反应为缩聚反应
C.PPV与聚苯乙烯的最小结构单元组成相同
D.1mol
最多可与2molH2发生反应
难度: 简单查看答案及解析
-
Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
难度: 中等查看答案及解析
-
设NA为阿伏加罗常数值,下列有关叙述正确的是
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1mol N2与4mol H2反应生成的NH3分子数为2NA
C.1mol Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24L CCl4含有的共价键数为0.4NA
难度: 困难查看答案及解析
-
下列选用的仪器和药品能达到实验目的的是
A
B
C
D
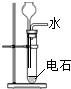
NaHSO3溶液

制乙炔的发生装置
蒸馏时的接收装置
除去SO2中的少量HCl
准确量取一定体积K2Cr2O7标准溶液
难度: 中等查看答案及解析
-
化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是
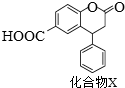
A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.1mol化合物X最多能与2molNaOH反应
难度: 中等查看答案及解析
-
在CH3COOH
CH3COO-+H+的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
难度: 中等查看答案及解析
-
下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O
D.稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
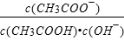 增大
增大C.向盐酸中加入氨水至中性,溶液中
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 困难查看答案及解析
-
下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极
B.金属护拦表面涂漆
C.汽车底盘喷涂高分子膜
D.地下钢管连接镁块
难度: 中等查看答案及解析
-
常温下,Ksp(CaSO4)=9×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是
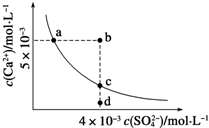
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定不等于3×10-3mol•L-1
D.向d店溶液中加入适量CaCl2固体可以变到c点
难度: 中等查看答案及解析
-
现有pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L,其pH与溶液体积的关系如图所示,下列说法正确的是

①A是强酸或比B强的弱酸,B是弱酸
②稀释后,A溶液的酸性比B溶液强
③若A、B均为弱酸,则2<a<5
④若A、B均为强酸,则A、B的物质的量浓度一定相等
A.①② B.①③ C.①③④ D.②③④
难度: 困难查看答案及解析
-
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g).设起始
=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是( )
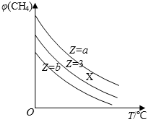
A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
难度: 困难查看答案及解析