-
下列物质中属于弱电解质的是
A. HF B. HNO3 C. NH3 D. AgCl
难度: 简单查看答案及解析
-
某酸碱指示剂是一种有机弱酸,其在水溶液中呈现的颜色与其电离平衡相关:HA(红色)
H++A-(黄色),若要使该指示剂呈黄色,则应加入
A. H2SO4 B. HCl C. NaOH D. NaHSO4
难度: 简单查看答案及解析
-
升高温度,0.1 mol • L-1的NaCN溶液中浓度会增大的离子是
A. Na+ B. CN- C. H+ D. OH-
难度: 简单查看答案及解析
-
下列关于盐类水解的说法中正确的是
A. 任何盐均能发生水解 B. 溶液的pH —定变大
C. 使水的电离程度增大 D. 发生氧化还原反应
难度: 简单查看答案及解析
-
下列物质既能与盐酸反应,又能与NaOH溶液反应的是
A. (NH4)2CO3 B. AlCl3 C. NaAlO2 D. CH3COONa
难度: 简单查看答案及解析
-
对于化学反应:2SO2+O2
2SO3,当分别用SO2、O2、SO3三种物质表示该反应的速率时,它们的速率之比为
A. 1:2:2 B. 2:1:2 C. 2:2:1 D. 1:1:2
难度: 简单查看答案及解析
-
下列对化学反应平衡常数(K)的叙述正确的是
A. 仅升髙温度,K可能增大,也可能减小 B. 仅加入催化剂,K可能增大
C. 仅增大压强,K可能减小 D. 仅减小浓度,K值可能减小
难度: 中等查看答案及解析
-
在一体积可变的密闭容器中发生反应:2M(g)+N(s)
3P(g) △H<0。下列有关说法正确的是
A. 该反应在常温下不能自发进行
B. 达到平衡后,再加入一定量的N,平衡正向移动
C. 达到平衡后,再增大容器体积,反应速率加快
D. 达到平衡后,再升高温度,平衡逆向移动
难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存的是( )
A. H+、Fe2+、Cl-、NO3- B. Mg2+、K+、OH-、Cl-
C. NH4+、Ca2+、NO3-、CO32- D. K+、H+、Cl-、SO42-
难度: 中等查看答案及解析
-
下列关于酸碱中和滴定的说法正确的是
A. 强酸滴定弱碱时可用酚酞作指示剂
B. 滴定时向待测液中滴入标准液的速率应先快后慢
C. 滴定过程中,眼睛应始终注视着滴定管的刻度线
D. 若操作无失误,只需滴定—次即可
难度: 中等查看答案及解析
-
T℃时,在—恒容密闭容器中发生反应:2NH3(g)
N2(g)+3H2(g)。下列叙述中不能说明反应已达到平衡的是
A. NH3的生成速率与NH3的分解速率相等
B. 单位时间内消耗2a mol NH3的同时生成amolN2
C. 容器内的压强不再变化
D. 混合气体的平均摩尔质量不再变化
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. FeBr2溶液中通入过量Cl2:2Fe2++4Br-+3Cl-=2Fe3++2Br2+6Cl-
B. 氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
C. NaHCO3 溶液中加入过量石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D. H2O2溶液中加入酸性KMnO4溶液:2 MnO4-+5 H2O2=2Mn2++5O2↑+2H2O+6OH-
难度: 简单查看答案及解析
-
向一体积为1 L的恒容密闭容器中充入2molPCl3和2molCl2,发生反应:PCl3(g)+Cl2(g)
PCl5(g)。达到平衡时,PCl5的物质的量为1mol,若此时移走1mol PCl5,则在相同温度下再达到平衡时,PCl5的物质的量约为
A. 0.38mol B. 0.50mol C. 0.63mol D. 0.71mol
难度: 中等查看答案及解析
-
常温下,下列有关0.lmol·L-1的NH4Cl溶液的说法正确的是
A. pH相同的盐酸与氯化铵溶液中,水的电离程度相同
B. 加入少量Mg(OH)2固体,c(NH4+)减小
C. 溶液加水稀释时,
逐渐增大
D. 加入等体积0. 05 mol • L-1的NaOH溶液时: c(Na+) =c(Cl-) >c(NH4+)>c(OH-)>c( H+)
难度: 简单查看答案及解析
-
H2O与D2O的pKw(p/Cw=-lgKw)与温度的关系如图所示,下列有关说法正确的是
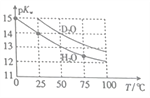
A. 常温下,向D2O中加入DCl,pKw变大
B. 25℃时,纯D2O的pH等于7
C. 25℃时,pH=7的液体一定是纯H2O
D. D2O的电离过程为吸热过程
难度: 中等查看答案及解析
-
下列推断正确的是
A. pH=6.5的溶液一定显酸性
B. 0.1mol • L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol • L-1
C. 常温下,等体积的0.2 mol • L-1的盐酸与0.2 mol • L-1的氢氧化钡溶液混合,所得溶液的pH=13
D. 常温下,某溶液中水电离出的c(OH-)=l×10-12 mol • L-1,该溶液pH 一定等于2
难度: 简单查看答案及解析
-
向恒温恒容密闭容器中充入气体A,发生反应:xA(g)
yB(g)+zC(g),各物质的浓度随时间的变化如下表所示。
时间/s
c(A)/mol • L-1
c(B)/mol • L-1
c(C)/mol • L-1
0
0.540
0
0
5
0.530
0.015
0.020
15
0.514
0.039
0.052
30
0.496
0.066
0.088
下列说法正确的是
A. x+y=3
B. 若起始时在容器中通入氦气,使容器压强增大,各物质反应速率均加快
C. 随着反应的进行,A的反应速率不断减慢,是因为该反应是吸热反应
D. 0~30 s内B的平均生成速率为2.2×10-3 mol • L-1 • S-1
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是
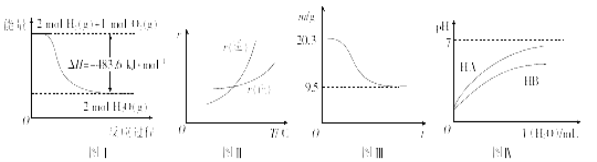
A.图I表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H = - 241.8 kJ.mol-1
B.图Ⅱ表示某可逆反应正、逆反应速率随温度的变化,则该反应的正反应是放热反应
C.图Ⅲ表示0.1 mol MgCl2.6H2O在空气中充分加热时固体质量随时间的变化
D.图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
难度: 中等查看答案及解析
-
下列说法正确的是
A. 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:
c(Na+)=c(SO4-)>c(NH4+)>c(H+)>c(OH-)
B. 25℃时,0.1mol • L-1的HA溶液中
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,沉淀溶解平衡:BaSO4(s)
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
难度: 简单查看答案及解析
-
某温度下的4 L密闭容器中,X、Y、W 3种气体起始状态和平衡状态时的物质的量如下表所示。下列说法正确的是
气体
X
Y
W
n(起始状态)/mol
2
1
0
n(平衡状态)/mol
1
0.5
1.5
A. 此反应的平衡常数表达式为K=
B. 达到平衡后,升高温度,W的体积分数减小,则此反应的△H>0
C. 达到平衡后,将容器体积压缩为2 L,W的物质的量浓度变为0.75mol·L-1
D. 达到平衡后,增大压强,正、逆反应速率均增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
在某恒温密闭容器中,投入一定量的A发生可逆反应:A(s)
B(g)+C(g) △H=-QkJ·mol-1(Q>0)。一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡。下列分析不正确的是
A. 两次平衡时,C(g)的浓度相等
B. 平衡时,单位时间内:n(B)生成:n(C)消耗=1:1
C. 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收Q kJ热量
D. 若再向平衡体系中加入少量A,平衡不移动
难度: 简单查看答案及解析
-
某温度时,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+ ),所需S2-最低浓度的对数值lgc(S2-)与lg(M2+)的关系如图所示。下列说法正确的是
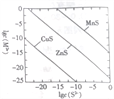
A. 三种离子对应的硫化物中Ksp(CuS)最小,约为1×10-20
B. 可用MnS除去MnCl2溶液中混有的少量杂质ZnCl2
C. 向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大
D. 向浓度均为1×10-5 mol·L-1的Cu2+、Zn2+、Mn2+混合溶液中逐滴加入l×l0-4 mol·L-1的Na2S溶液,Zn2+最先沉淀
难度: 简单查看答案及解析
-
一定温度下,在三个体积均为2 L的恒容密闭容器中发生反应:CO2(g)+H2S(g)
COS(g)+H2O(g)。
容器
温度/K
起始物质的量/mol
平衡物质的量/mol
平衡常数
CO2
H2S
H2O
I
607
0.1
0.15
0.05
Ⅱ
607
0.2
0.3
Ⅲ
627
0.1
0.15
6×l0-3
下列说法正确的是
A. 该反应为吸热反应
B. 容器Ⅲ达到平衡时,再充入少量氦气,平衡将向正反应方向移动
C. 容器Ⅱ达到平衡时,容器中COS的物质的量浓度为0.025 mol • L-1
D. 607 K时,该反应的平衡常数为0.50
难度: 简单查看答案及解析
-
室温时,3.5 mol·L-1的二元弱酸H2R溶液中H2R、HR-、R2三种微粒所占物质的量分数(ɑ)随pH的变化趋势如图所示。下列说法正确的是

A. H2R的一级电离平衡常数Ka1≈4.0
B. pH=2.5的H2R溶液中:c(HR-)+c(R2-)+c(OH-)=10-2.5
C. pH=5.5的该溶液中:c(HR-)>c(R2-)>c(H+)>c(OH-)
D. 向pH=7的该溶液中滴加少量稀硫酸,a(HR-)减小
难度: 中等查看答案及解析
-
T℃时,在容积为2L的3个恒容密闭容器中发生反应:3A(g)+B(g)
xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器
甲
乙
丙
反应物的投入量
3molA、2molB
6molA、4molB
2molC
还到平衡的时间/min
5
8
A的浓度/mol • L-1
cl
c2
O
C的体积分数/%
ω1
ω3
混合气体的密度/g·L-1
ρ1
ρ2
下列说法正确的是
A. 若x<4,则2c1<c2
B. 若x=4,则ω1=ω3
C. 无论x的值是多少,均有2ρ1=ρ2内
D. 容器甲中反应从开始到平衡的平均反应速率可能为v(A)=0.3mol·L-1·min-1
难度: 简单查看答案及解析