-
化学与社会、科学、技术、环境(STSE)密切联系。下列说法正确的是
A. 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅
B. 手机外壳上贴的碳纤维外膜是一种新型无机非金属材料
C. 用淀粉溶液可以直接检验海水中是否含碘元素
D. 明矾净水的原理和“84”消毒液消毒的原理相同
难度: 中等查看答案及解析
-
粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示。下列有关粘氯酸的说法不正确的是
A. 分子式为C4H2Cl2O3
B. 能使酸性高锰酸钾溶液褪色
C. 1mol粘氯酸与足量NaHCO3溶液反应,能产生标准状况下22.4LCO2
D. 粘氯酸与足量H2反应生成M,则含一个甲基的M的同分异构体只有3种
难度: 困难查看答案及解析
-
新装修房屋会释放有毒的甲醛(HCHO)气体,银-Ferrozine法检测甲醛的原理如下:
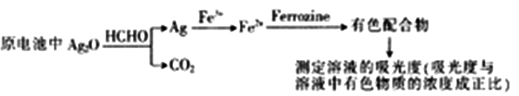
下列说法正确的是
A. 22.4LCO2中含共价键数目为4NA
B. 30gHCHO被氧化时转移电子数目为2 NA
C. 该电池总反应的化学方程式为2Ag2O+HCHO=4Ag+CO2↓+H2O
D. 理论上,消耗HCHO和消耗Fe3+的物质的量之比4:1
难度: 困难查看答案及解析
-
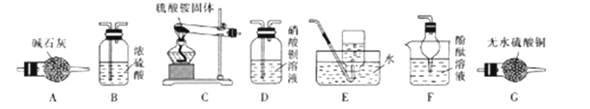
利用如图装置进行实验,下列有关实验操作和现象正确的是
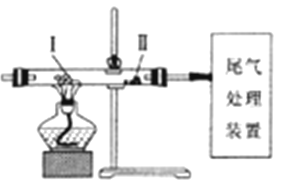
A. 缓慢通入N2,再加热Ⅰ处的碳酸氢钠,可观察到Ⅱ处过氧化钠粉末由浅黄色变成白色
B. 缓慢通入N2,加热Ⅰ处KClO3和MnO2的混合物,可观察到Ⅱ处干燥KI淀粉试纸变成蓝色
C. 先对Ⅰ处的氯化铵加热,再缓慢通入N2,可看到Ⅰ处固体减少,Ⅱ处无固体沉积
D. 先缓慢通入CO2,再加热Ⅰ处炭粉,可观察到Ⅱ处氧化铁粉末由红色变成黑色
难度: 困难查看答案及解析
-
短周期主族元素M、R、X、Y的原子序数依次增大,其中只有X属于金属元素,有M、R、X可组成一种化合物Q,298K时,0.1mol·L-1Q溶液是AG(酸度)=lg
=-12,由M和Y组成的化合物MY是强电解质。下列说法正确的是
A. 简单离子半径:Y>R>X B. Y的氧化物对应的水化物一定是强酸
C. X分别与M、R、Y组成的二元化合物中都只含离子键 D. 化合物XRM和XYR均能抑制水的电离
难度: 困难查看答案及解析
-
下图是一种正在投入生产的大型蓄电池系统的原理图,电池中的左右两侧为电极,中间为钠离子选择性膜(电池放电和充电时该膜只允许钠离子通过),电池充、放电时反应的化学方程式为2Na2S2+NaBr2
Na2S4+3NaBr。下列关于此电池的说法错误的是
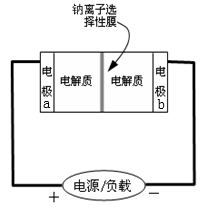
A. 电极a接触到的电解质溶液为Na2S2-Na2S4混合溶液
B. 放电过程中,钠离子从电极b通过钠离子选择性膜移动到电极a
C. 电池放电时,负极的电极反应式为3Br--2e-=Br3-
D. 充电过程中,当有0.1molNa+通过钠离子选择性膜时,导线中通过0.2mol电子
难度: 困难查看答案及解析
-
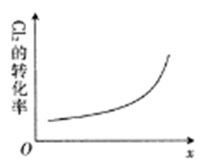
25℃时,向20mL0.1mol·L-1H3PO2溶液中滴加0.1mol·L-1的NaOH溶液,滴定曲线如图1,含磷微粒物质的量浓度所占分数(δ)随pH变化关系如图2。下列说法不正确是
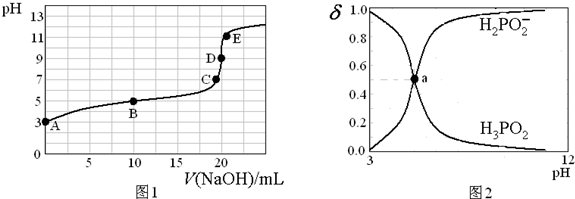
A. H3PO2的电离方程式为H3PO2
H2PO2-+H+ Ka≈10-5
B. B点时,溶液中存在关系:2c(H+)+c(H2PO2-)=2c(OH-)+c(H3PO2)
C. C点时,溶液中存在关系:c(Na+)+c(H+)=C(H2PO2-)+c(OH-)
D. D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
难度: 困难查看答案及解析

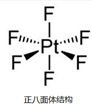
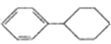 结构
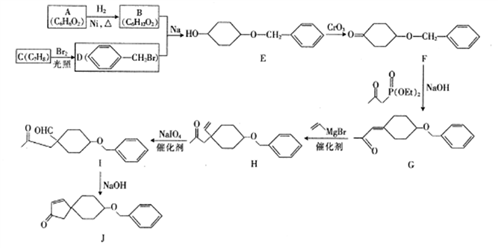
结构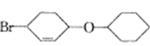 的合成路线流程图(无机试剂任选,可选择适当有机溶剂)。________合成路线流程示例如下:
的合成路线流程图(无机试剂任选,可选择适当有机溶剂)。________合成路线流程示例如下: