-
能增加反应物分子中活化分子的百分数的是
A.降低温度 B.使用催化剂 C.增大压强 D.增加浓度
难度: 简单查看答案及解析
-
在2L的密闭容器中,发生3A(g)+B(g)
2C(g)的反应,若最初加入A和B都是4mol,10s后,测得υ(A)=0.12mol/(L•s),则此时容器中B的物质的量是
A.2.4mol B.0.8mol C.3.2mol D.1.6mol
难度: 简单查看答案及解析
-
压强变化不会使下列化学反应的平衡发生移动的是
A.H2(g)+I2 (g)
2HI (g) B.3H2(g)+N2(g)
2NH3(g)
C.2SO2(g)+O2(g)
2SO3 (g) D.C(s)+CO2(g)
2CO(g)
难度: 简单查看答案及解析
-
下列物质与HNO3反应时,硝酸既表现出强氧化性又表现出酸性的是:
A.Fe2O3 B.FeS C.Cu(OH)2 D.C
难度: 简单查看答案及解析
-
砷为第四周期第ⅤA族元素,则砷不可能具有的性质:
A.砷通常情况下是固体 B.砷可以有-3、+3、+5等多种化合价
C.As2O5对应水化物酸性比H3PO4弱 D.砷的非金属性比磷强
难度: 简单查看答案及解析
-
下列叙述不正确的是:
A.五氧化二磷只是磷酸的酸酐
B.二氧化氮不是硝酸的酸酐
C.安全火柴盒的侧面所涂的物质是一种混合物,其中含有红磷和三硫化二锑等
D.含磷的废水拍到自然水中,能引起藻类增殖,使水变质,必须除去
难度: 简单查看答案及解析
-
NH4H与NH4 Cl的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是:
A. NH4H是离子化合物
B. NH4H溶于水,所形成的溶液显酸性
C. NH4H与水反应时,NH4H是还原剂
D. NH4H固体投入少量的水中,有两种气体生成
难度: 简单查看答案及解析
-
下列除去杂质的操作方法正确的是
A.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
B.氯化铵中少量的碘:加热
C.CO2中混有少量的HCl:通过饱和的NaHCO3溶液后再干燥
D. N2中混有少量的NO2:通过水洗涤
难度: 简单查看答案及解析
-
下列试剂,必须用棕色瓶盛装的是:
①浓氨水 ②氯水 ③硝酸银 ④浓硝酸 ⑤浓盐酸 ⑥溴化银
A. ①②③④⑤⑥ B. ②③④⑥ C. ②③⑤⑥ D. ①③④⑥
难度: 简单查看答案及解析
-
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶.则a和b分别是
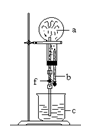
a(干燥气体)
b(液体)
A
NO
NaOH溶液
B
Cl2
饱和NaCl溶液
C
CO2
KOH溶液
D
NO2
水溶液
难度: 简单查看答案及解析
-
现有反应4NH3+5O2==4NO+6H2O,反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,其关系正确的是
A.4v(NH3)=5(O2) B.4 v(NH3)=6 v(H2O)
C.4v(O2)=5 v(NO) D.4 v(NH3)=5 v(NO)
难度: 简单查看答案及解析
-
下列事实不能用勒夏特利原理来解释的是
A.光照新制的氯水时,溶液中酸性逐渐增强
B.加催化剂使N2和H2在一定条件下转化为NH3
C.增大压强,有利于SO2和O2反应生成SO3
D.在Fe3++3KSCN Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
难度: 简单查看答案及解析
-
在一定温度下,可逆反应A(g)+3B(g)
2C(g),在密闭容器中反应,达到平衡状态的标志是
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)混合气体的总压强不再变化;(5)速率V(A):V(B):V(C)=1:3:2;(6)条件一定,混和气体的平均相对分子质量不再变化;(7)A、B、C的分子数目比为1:3:2。
A.(1)(2)(4)(7) B.(2)(3)(5)(6)
C.(1)(3)(4)(6) D.(1)(3)(5)(7)
难度: 简单查看答案及解析
-
在一固定体积的密闭容器中,加入2molA和3molB,发生反应如下:
2A(气)+3B(气)
3C(气)+D(气)当反应达到平衡时,C的浓度为Wmol/L若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L的是
A.1molA+1.5molB+1.5molC+0.5molD B.4molA+6molB
C.2molA+3molB+3molC+1molD D.6molC+2molD
难度: 简单查看答案及解析
-
在某温度下,反应ClF(g)+F2(g)
ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是
A.温度不变,缩小体积,ClF的转化率增大
B.温度不变,增大体积,ClF3的产率提高
C.升高温度,增大体积,有利于平衡向正反应方向移动
D.降低温度,体积不变,F2的转化率降低
难度: 简单查看答案及解析
-
在一密闭的容器中,反应aA(g)
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a > b
难度: 简单查看答案及解析
-
下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2
N2O4(正反应为放热反应)
B.3O2
2O3(正反应为吸热反应)
C.H2(g)+I2(g)
2HI(g) (正反应为放热反应)
D.NH4HCO3(s)
NH3(g)+H2O(g)+CO2(g) (正反应为吸热反应)
难度: 简单查看答案及解析
-
在一定温度不同压强(P1<P2)下,可逆反应2X(g)
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是

难度: 简单查看答案及解析
-
下图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是
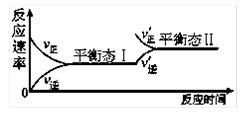
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
难度: 简单查看答案及解析
-
工业上合成氨时一般采用500℃左右的温度,其原因是
(1)适当提高氨的合成速率(2)提高氢气的转化率(3)提高氨的产率
(4)催化剂在5000C时活性最大
A.只有(1) B. (1)(2) C.(2)(3)(4) D.(1)(4)
难度: 简单查看答案及解析
-
还原2.4 molXO(OH)3+到X元素的低价态时,需消耗3 mol/L
的Na2SO3溶液2L,则在此反应中X元素的低价态为:
A.0价 B.+1价 C. -1价 D.-2价
难度: 简单查看答案及解析
-
2.24g铁屑与30mL2 mol/L盐酸充分反应后,溶液中FeCl2的物质的量为:
A.0.02 mol B.0.03mol C.0.04mol D. 0.06mol
难度: 简单查看答案及解析
