-
以下食品化学知识的叙述不正确的是
A、食盐可作调味剂,也可作食品防腐剂
B、新鲜蔬菜做熟后,所含维生素C会有损失
C、纤维素在人体内可水解为葡萄糖,故可做人类的营养物质
D、葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒。
难度: 简单查看答案及解析
-
一定条件下存在反应:CO(g)+H2O(g)
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO的物质的量比容器II中的多
D.容器I中CO的转化率与容器II中CO2的转化率之和等于1
难度: 简单查看答案及解析
-
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:

① b<f ② 915℃、2.0MPa时E的转化率为60%
③ 该反应的△S>0 ④ K(1000℃)>K(810℃)
上述①~④中正确的有
A.4个 B.3个 C.2个 D.1个
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中发生反应X(g) + Y(g)
2Z(g)△H < 0,一段时间后达到平衡。反应过程中测定的数据如下
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
难度: 简单查看答案及解析
-
已知2SO2(g)+O2(g)
2SO3(g)△H=-197kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2molSO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
难度: 困难查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO3(s) + CO(g)
MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项
x
y
A
温度
容器内混合气体的密度
B
CO的物质的量
CO2与CO的物质的量之比
C
SO2的浓度
平衡常数K
D
MgSO4的质量(忽略体积)
CO的转化率
难度: 困难查看答案及解析
-
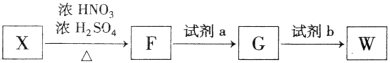
下列实验事实不能用平衡移动原理解释的是
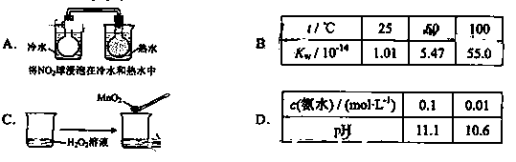
难度: 中等查看答案及解析
-
25 ℃时在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn)发生反应Sn(s)+Pb2+(aq)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
难度: 困难查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是

A.CO2(g)+2NH3(g)
CO(NH2)2(s)+H2O(g);ΔH<0
B.CO2(g)+H2(g)
CO(g)+H2O(g);ΔH>0
C.CH3CH2OH(g)
CH2=CH2(g)+H2O(g);ΔH>0
D.2C6H5CH2CH3(g)+O2(g)
2C6H5CH=CH2(g)+2H2O(g);ΔH<0
难度: 困难查看答案及解析
-
在等温等容条件下,有下列气体反应:2A(g)+2B(g)
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L。Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是( )
A.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的平均相对分子质量不同
B.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同
C.达到平衡时Ⅰ途径的VA等于Ⅱ途径的VA
D.达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的1/2
难度: 困难查看答案及解析
-
一个真空密闭恒容容器中盛有1molPCl5,加热到200℃发生如下反应:PCl5(g)
PCl3 (g)+Cl2 (g),反应达到平衡时,混合气体中PCl5所占体积分数为M%。若同一温度的同一容器中,最初投入2 molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%。则M和N的关系是
A.M>N B.M=N C.M<N D.无法确定
难度: 困难查看答案及解析
-
反应N2O4(g)
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
难度: 困难查看答案及解析
-
在一个不导热的密闭容器中,只发生两个反应:a(g) + b(g)
2c(g);△H<0 x(g) + 3y(g)
2z(g);△H>0,进行相关操作且达到平衡后,(忽略体积改变所做的功)下列叙述错误的是( )
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
难度: 中等查看答案及解析



 的单体。
的单体。