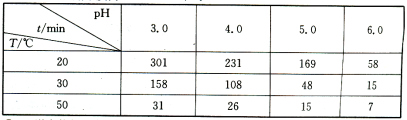
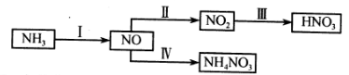
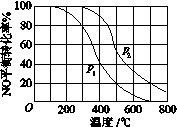
-
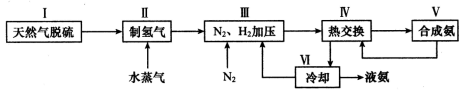
美国亚利桑那州大学(ASU)和阿贡国家实验室的科学家设计出生产氢气的人造树叶,原理为:2H2O(g)
2H2(g)+O2(g)。有关该反应的说法正确的是
A.△H <0 B.△S <0
C.化学能转变为电能 D.氢能是理想的绿色能源
难度: 简单查看答案及解析
-
通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,是为了加快化学反应速率的是
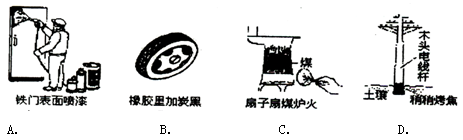
难度: 简单查看答案及解析
-
已知H2(g)+Cl2(g)==2HCl(g) △H=―184.6kJ·mol—1,则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为
A.+184.6kJ·mol—1 B.+92.3kJ·mol—1
C.―184.6kJ·mol—1 D.―92.3kJ·mol—1
难度: 简单查看答案及解析
-
下列反应中属于放热反应的是
A.电解Al2O3得到Al和O2 B.石灰石高温分解为生石灰和二氧化碳
C.铝粉与氧化铁高温反应 D.Ba(OH)2·8H2O和NH4Cl晶体混合反应
难度: 简单查看答案及解析
-
改变外界条件可以影响化学反应速率,对反应H2(g)+I2(g)
2HI(g),其中能使活化分子百分数增加的是:①升高体系的温度 ②增加反应物浓度 ③增大气体的压强 ④使用催化剂
A.①③ B.①④ C.②③ D.③④
难度: 简单查看答案及解析
-
在恒温时,一固定容积的容器内发生反应:PCl5(g)
PCl3 (g)+Cl2(g)。达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度
A.增大 B.减小 C.不变 D.无法判断
难度: 中等查看答案及解析
-
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.升高温度 B.加入一种反应物
C.对平衡体系增加压强 D.使用催化剂
难度: 简单查看答案及解析
-
对于平衡CO2(g)
CO2(aq) ΔH=-19.75 kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是
A.升温增压 B.降温减压
C.升温减压 D.降温增压
难度: 简单查看答案及解析
-
在一定温度下,容积不变的密闭容器中发生反应:C(s)+H2O(g)
CO(g)+H2(g),下列叙述不能认定该可逆反应已经达到平衡状态的是
A.混合气体压强不再发生变化
B.混合气体质量不再发生变化
C.反应中CO与H2的物质的量之比为1︰1
D.生成nmol CO的同时生成nmol H2O
难度: 简单查看答案及解析
-
下列相关实验示意图不能达到实验目的的是

难度: 中等查看答案及解析
-
条件一定时,反应2A(g)+B(g)
2C(g),B的转化率α与温度T变化关系曲线图如下所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是

A.a B.b C.c D.d
难度: 简单查看答案及解析
-
反应A(g)+2B(g)===C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是
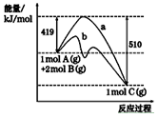
A.正反应活化能大于逆反应活化能
B.曲线b表示使用催化剂后的能量变化
C.由图可知该反应的焓变ΔH=+ 91 kJ·mol-1
D.反应中将气体A换为固体反应,其他条件不变,反应放出热量小于91kJ
难度: 简单查看答案及解析
-
下列推论正确的是
A.H2(g)的燃烧热是285.8 kJ·mol-1,则H2O(g)=2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
B.对于反应2H2O2==2H2O+O2↑,升高温度能加快O2的生成速率
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
D.在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl—
[CuCl4]2—(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色
难度: 简单查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是
A.B的转化率降低 B.平衡向正反应方向移动
C.x+y<z D.C的体积分数增大
难度: 中等查看答案及解析
-
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是
温度/℃
25
80
230
平衡常数
5×104
2
1.9×10-5
A.上述生成Ni(CO)4的反应为吸热反应
B.25 ℃时,反应Ni(CO)4(g)
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
D.80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时υ(正)>υ(逆)
难度: 中等查看答案及解析