-
(14分)针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ·mol-1)的实验装置如图所示。
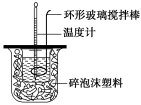
某兴趣小组的实验数值结果小于57.3 kJ·mol-1,原因可能是 (填字母)。
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定
H2SO4溶液的温度
(2)利用氢气可以制取工业原料乙酸。已知:
a.CH3COOH(l)+2O2(g) ==2CO2(g)+2H2O(l) △H = —870.3kJ/mo1
b.C(s)+O2(g) ==CO2(g) △H = —393.5kJ/mo1
c.H2(g) +1/2 O2(g)==H2O(l) △H = —285.8kJ/mo1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是 。
②利用上述信息计算下述反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= kJ/mol。
(3)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
①写出此条件下,反应A的热化学方程式__________________ _______。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
-
针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ.mor1)的实验装罝如图所示。
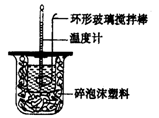
某兴趣小组的实验数值结果小于57.3 kJ/mol,原因可能是________(填字母)。
A.实验装罝保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4 溶液的温度
(2)利用氢气可以制取工业原料乙酸。己知:
A.CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJ/mo1
B.C(s)+O2(g)=CO2(g) △H=-393.5kJ/mo1
C.H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mo1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是___________。
②利用上述信息计算下述反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= kJ/mol 。
(3)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应 A: 4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。

ⅱ.
①写出此条件下反应A的热化学方程式是________________。
断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ。
-
测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
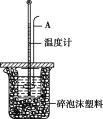
(1)理论上强酸、强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和氢氧化钠稀溶液反应的中和热的热化学方程式: ____________________。
(2)仪器A的名称是 _____________;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH_____________ (填“偏大”“偏小”或“无影响”)。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: ___________
| 
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH= _____________(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_____________ (填序号)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
-
(11分)测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
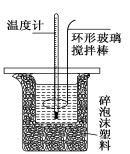
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol): ;
(2) 装置图中碎泡沫塑料所起作用为: ;
(3) ①取50 mL NaOH溶液和30 mL硫酸溶液进行实验,
实验数据如下表.请填写下表中的空白:
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
| | | | | |
②若上述实验所测中和热数值偏小,产生偏差的原因可能是( )
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
-
下列与化学反应能量变化相关的叙述正确的是
A. 浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
B. 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
-
某小组同学进行氢氧化钠与硫酸反应的中和热测定实验时,数值结果小于57.3kJ·mol-1,产生偏差的原因不可能是
A.实验装置保温、隔热效果差
B.所用硫酸为浓硫酸
C.玻璃搅拌器改为铜质搅拌器
D.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液
-
下列过程都与热量变化有关,其中表述不正确的是 ( )
A.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+1/2 O2(g)=CO2(g) ΔH=-283.0 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.醋酸的电离过程是吸热过程,升高温度,醋酸的Ka增大、pH减小
-
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。某兴趣小组的实验数值结果大于57.3 kJ·mol-1(中和热),原因可能是
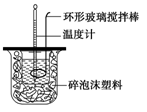
A.实验装置中小烧杯杯中低于大烧杯杯口
B.用浓硫酸代替了稀硫酸
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
-
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。某兴趣小组的实验数值结果大于57.3 kJ·mol-1(中和热),原因可能是

A.实验装置中小烧杯杯中低于大烧杯杯口
B.用浓硫酸代替了稀硫酸
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
-
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。某兴趣小组的实验数值结果大于57.3 kJ·mol-1(中和热),原因可能是
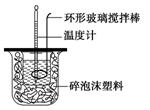
A.实验装置中小烧杯杯中低于大烧杯杯口
B.用浓硫酸代替了稀硫酸
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度

2Cl2+2H2O








