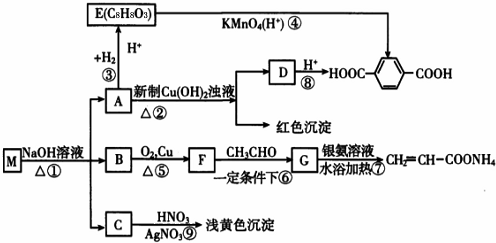
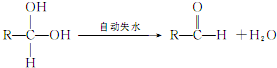
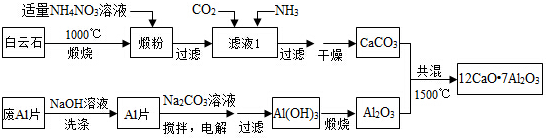
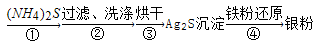-
下列说法中正确的是
A.食品中大理添加苯甲酸钠等防腐剂,可以有效延长其保持期
B.利用丁达尔效应可区分淀粉溶液和NaCl溶液
C.明矾能水解生成Al(OH)3胶体,可用作饮用水消毒杀菌
D.石油分馏属于化学变化
难度: 简单查看答案及解析
-
下列各离子组在指定溶液中能大量共存的是
A.强碱性溶液:Mg2+、NH4+、Cl-、NO3-
B.使甲基橙变红的溶液:Na+、Fe3+、Cl-、S2O32-
C.无色溶液中:K+、Al3+、HCO3-、Cr2O72-
D.常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、Na+、AlO2-、CO32-
难度: 中等查看答案及解析
-
下列说法正确的是
A.乙醇既可以发生催化氧化反应,又可以发生酯化反应
B.用溴水可以鉴别乙醇、乙酸和苯
C.糖类、油脂、蛋白质三类物质都只含有C、H、O三种元素
D.C5H10O属于醛类的同分异构体为六种
难度: 简单查看答案及解析
-
下列判断正确的是:
A.原子半径:S>O>N B.沸点:H2O>HF>H2S
C.离子半径:Cl->Al3+>Mg2+ D.还原性:I->S2->Br-
难度: 简单查看答案及解析
-
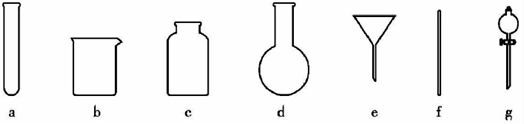
关于下列图示的说法中正确的是:

A.图①装置用于分离沸点相关较大的互溶液体混合物
B.图②装置用于研究不同催化剂对反应速率的影响
C.图③中电流计的指针发生偏转,石墨为正极
D.图④装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯
难度: 中等查看答案及解析
-
常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是:
A.某HCl溶液的pH值为2,则溶液中由水电离的c(H+)=10-2mol•L-1
B.0.1 mol•L-1的KHA溶液,其pH=10, c(K+)>c(A2-)>c(HA-)>c(OH-)
C.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后溶液pH>7,则反应后的混合液:c(HA)>C(Na+)>c(A-)
难度: 困难查看答案及解析
-
一定条件下合成乙烯:6H2(g)+2CO2(g)
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
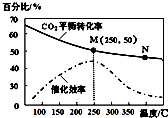
A.生成乙烯的速率:v(M)有可能小于v(N)
B.平衡常数:KM>KN
C.当温度高于250℃,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D.若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
难度: 极难查看答案及解析