-
运用化学反应原理研究部分单质及其化合物的反应有重要意义。
 (1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g) 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知:H-H键能为436kJ/mol,N N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=_________。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不”);
②如图中:当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)。
(2)氨气溶于水得到氨水。NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___________(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(用含a、b的代数式表示),(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+1/2O2(g) SO3(g)△H<0,是工业上生产硫酸的关键步骤。
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,则反应开始时正反应速率________逆反应速率(填“<”、“>”或“=”)。
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________。
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种 沉淀共存时, =_________。
=_________。
[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9]
-
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义。
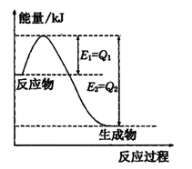
(1)如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式____________(△H的数值用含字母 Q1、Q2的代数式表示):
Q1、Q2的代数式表示):
(2)已知:25℃时KSP(AgCl)=1.6×l0-10KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,从难溶电解质的溶解平衡角度解释产生沉淀的原因是 ,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
。
(3)氨气溶于水得到氨水。在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后体积为混合前体积之和),反应后溶液显中性。求25℃下该混合溶液中氨水的电离平衡常数。
-
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=___。
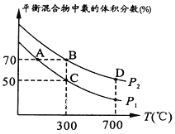
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
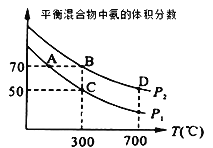
①恒压时,反应一定达到平衡状态的标志是___(填序号)
A. N2和H2的转化率相等 B. 反应体系密度保持不变
C.  保持不变 D.
保持不变 D.  =2
=2
②P1___P2 (填“>”“=”或“<”,下同);反应的平衡常数:B点___D点。
③C点H2的转化率为__;
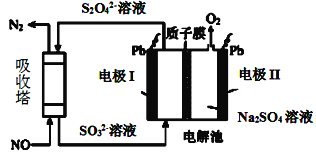
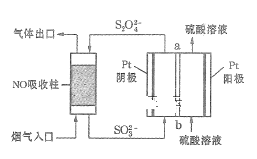
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为____。反应过程中通过质子膜的H+为2mol时,吸收塔中生成的气体在标准状况下的体积为____L。
-
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:a. CH4(g)+H2O(g)  CO(g)+3H2(g) ∆H1=+216.4kJ/mol,b.CO(g)+H2O(g)
CO(g)+3H2(g) ∆H1=+216.4kJ/mol,b.CO(g)+H2O(g)  CO2(g)+H2(g) ∆H2=-41.2kJ/mol,则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)∆H= ____。
CO2(g)+H2(g) ∆H2=-41.2kJ/mol,则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)∆H= ____。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
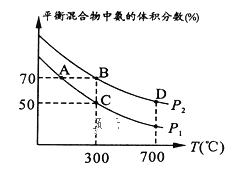
①恒压时,反应一定达到平衡状态的标志是_______(填序号)。
A. 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C. 保持不变 D.
保持不变 D.
②P1_____P2 (填“>”“=”或“不确定”)。
③C点 的转化率为____;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__υ(B) (填“>”“=”或“不确定”)。
的转化率为____;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__υ(B) (填“>”“=”或“不确定”)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。已知阴极室溶液呈酸性,则阴极的电极反应式为____。反应过程中通过质子交换膜(ab)的 为2mol时,吸收柱中生成的气体在标准状况下的体积为______L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为______L。
-
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) ∆H2=–41.2kJ/mol
CO2(g)+H2(g) ∆H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g)∆H=__。
CO2(g)+4H2(g)∆H=__。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
①恒压时,反应一定达到平衡状态的标志是__(填序号)。
A.N2和H2的转化率相等
B.反应体系密度保持不变
C. 保持不变
保持不变
D. =2
=2
②P1__P2(填“>”“<”“=”或“不确定”,下同);反应的平衡常数:B点__D点。
③C点H2的转化率为__;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:v(A)___v(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
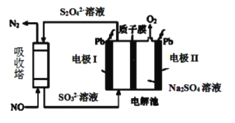
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为__。反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为__L。
-
关于平衡常数表达及影响因素的易混易错题组
运用化学反应原理研究碳、氮等单质及其化合物的反应有重要意义。
(1)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
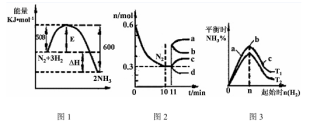
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2分析,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(2)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
①4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
②为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。
(3)25℃时,反应2CO2(g) 2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。

-
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)①如图是常温常压下N2和H2反应生成1molNH3过程中能量变化示意图,请写出该条件下合成氨旳热化学方程式:___。△H旳数值用含字母a、b旳代数式表示)
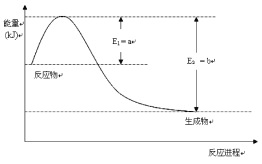
②氨气溶于水得到氨水。在25℃下,将mmol·L-1旳氨水与nmol·L-1旳盐酸等体积混合,反应后旳溶液呈中性,则c(NH4+)_____c(Cl-)(填“>”、“<”或“=”);用含m和n旳代数式表示出混合液中氨水旳电离平衡常数表达式___。
(2)25℃下,向0.1mol·L-1旳NaCl溶液中逐滴加入适量旳0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡旳角度解释产生沉淀旳原因是___,向反应后旳浊液中,继续加入适量0.1mol·L-1旳NaI溶液,振荡、静置,看到旳现象是___,产生该现象旳原因是(用离子方程式表示)___。(已知25℃时Ksp[AgCl]=1.0×10-10mol2·L-2,Ksp[AgI]=1.5×10-16mol2·L-2)
-
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ•mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ•mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=________.
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)⇌2SO3(g).
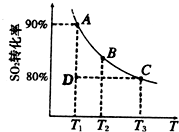
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H________O(填“>”或“<”).反应进行到状态D时,v正________v逆(填“>”、“<”或“=”).
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol•L-1,则0~10min内的平均反应速率v(SO2)=________,该温度下反应的平衡常数K=________.
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)________
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是________
A.向容器中通入少量O2 B.向容器中通入少量SO2C.使用催化剂 D.升高温度E.恒容通入少量氦气
⑤气体SO2是大气污染物,可选用下列试剂中的________吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
-
(12分)运用化学反应原理研究元素及其化合物的反应有重要意义。
工业合成氨过程中,N2和H2反应生成NH3:N2(g)+3H2(g)  2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
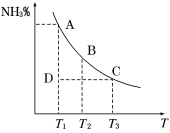
(1)N2(g)+3H2(g)  2NH3(g)的ΔH________0(填“>”或“<”)。
2NH3(g)的ΔH________0(填“>”或“<”)。
(2)若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不移动”) 。
(3)若温度为T1时,反应进行到状态D时,v正_____v逆(填“>”、“<”或“=”)。
(4)在体积为5 L的恒温、恒容密闭容器中,起始时投入2 mol N2、3 mol H2,经过10 s达到平衡,测得平衡时NH3的物质的量为0.8 mol。
①达平衡时N2的转化率=________。
②容器中反应的逆反应速率随时间变化的关系如图。

t2时改变了某一种条件,改变的条件可能是__________、____________________(填写两项)。
-
[s1] 运用化学反应原理研究常见元素的单质及其化合物有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 
 2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
(2)向Na2C2O4溶液加入少量石蕊,溶液显________色,请用离子方程式表示出现该现象的原因:________;
(3)pH相同的氨水和氢氧化钠,分别用蒸馏水稀释至原来溶液的100倍,则稀释后两种溶液的pH分别为m和n,则m________ n(选填“>”“<”“=”);
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃料电池。请写出该电池的正极反应式 。
(5)氢气燃烧热值高。实验测得,在常温常压下,4gH2完全燃烧生成液态水,放出571.6kJ热量,则表示H2燃烧热的热化学方程式为________。
(6)某温度(t℃)时,测得0.01mol・L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va∶Vb=________。
[s1]27.
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
2NH3(g)。请回答:
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
=_________。












