-
C、N、S元素都是生命体的重要组成元素,它们在自然界的平衡已受到较大的破坏。C、N、S元素在地球大气圈、岩石圈、水系、生物圈的循环过程中会产生的物质是
①HNO3 ②CO2 ③糖类 ④CH4
A. ② B. ②③ C. ②③④ D. ①②③④
难度: 简单查看答案及解析
-
下列叙述不属于固氮的是
A. 工业上合成氨 B. NH3经催化氧化生成NO
C. 闪电时,大气中生成NO D. 豆科植物根部的根瘤菌使空气中的氮气转变为铵态氮肥
难度: 简单查看答案及解析
-
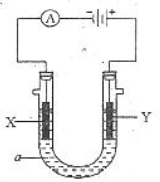
常温下,将铁片投入浓H2SO4中,下列说法正确的是
A. 不发生反应 B. 铁被钝化 C. 产生大量SO2 D. 产生大量H2
难度: 简单查看答案及解析
-
下列溶液不能区别SO2和CO2气体的是
A. 酸性高锰酸钾溶液 B. 品红溶液 C. 氢硫酸溶液 D. Ba(OH)2溶液
难度: 中等查看答案及解析
-
下列离子在稳定人体血液的pH中起作用的是
A. HCO3- B. Na+ C. Fe2+ D. Cl-
难度: 中等查看答案及解析
-
不能用勒夏特列原理解释的是
A. 使用铁触媒,加快合成氨反应速率 B. 实验室用排饱和食盐水法收集氯气
C. 打开汽水瓶盖,即有大量氕泡逸出 D. 温度升高,纯水中的H+浓度增大
难度: 中等查看答案及解析
-
在密闭容器中,反应2A+B
2C达到平衡后,增大压强,平衡向生成C的方向移动。对于A、B、C三种物质的状态判断正确的是
A. A是气体 B. B是气体
C. 如果C是气体,A、B一定是气体 D. 如果C是气体,B不一定是气体
难度: 中等查看答案及解析
-
在一定条件下,发生反应2NO2
N2O4,该反应达到化学平衡后,升高温度,混合物的颜色变深。下列有关说法正确的是
A. 正反应为放热反应 B. 正反应为吸热反应
C. 降温瞬间NO2的浓度增大 D. 降温后各物质的浓度不变
难度: 中等查看答案及解析
-
反应2A(g)
2B(g)+E(g)一Q(Q>0),达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A. 缩小体积加压 B. 使用催化剂 C. 增加A的浓度 D. 降温
难度: 中等查看答案及解析
-
下列物质中,属于电解质的是
A. 铁 B. 氯气 C. 二氧化碳 D. 氯化钾
难度: 简单查看答案及解析
-
下列物质在水溶液中,存在电离平衡的是
A. Ca(OH)2 B. H2S C. BaSO4 D. CH3COONa
难度: 简单查看答案及解析
-
不能说明醋酸是弱电解质的是
A. 醋酸钠溶液呈碱性 B. 醋酸溶液中存在醋酸分子
C. 醋酸溶液导电性差 D. 0.1mol/L醋酸溶液的pH=2.9
难度: 中等查看答案及解析
-
下列电离方程式中,正确的是
A. CH3COONH4→CH3COO-+NH4+ B. H2S
2H++S2-
C. NaHCO3→Na++H++CO32- D. Ba(OH)2
Ba2++20H-
难度: 中等查看答案及解析
-
室温下,pH=4的盐酸和pH=10的氨水等体积混合后,所得溶液的pH值
A. 一定小于7 B. 一定等于7 C. 一定大于7 D. 无法判断
难度: 中等查看答案及解析
-
在pH=2的无色溶液中能大量共存的离子组是
A. Na+、K+、HSO3-、NO3- B. Mg2+、ClO-、Na+、Cl-
C. NH4+、Al3+、SO42-、Br- D. MnO4-、NO3-、Ca2+、K+
难度: 中等查看答案及解析
-
常温下,由水电离的c(H+)=1.0×l0-13mol/L的溶液中一定不可能大量存在的离子是
A. NH4+ B. HCO3- C. OH- D. Fe3+
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. 硫化亚铁和稀盐酸反应:S2 -+2 H+→H2S↑
B. 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-→SO32-+H2O
C. 硫酸和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓
D. 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
能用H++OH-→H2O表示的是
A. NaHSO4+NaOH→Na2SO4+H2O B. CH3COOH+NaOH→CH3COONa+H2O
C. H2SO4+Ba(OH)2→BaSO4↓+2H2O D. NH3·H2O+HCl→NH4Cl+H2O
难度: 中等查看答案及解析
-
下列说法与盐类水解无关的是
A. 粗盐在空气中易潮解 B. NH4Cl用于金属焊接中除锈
C. 用热纯碱溶液去油污 D. 蒸干并灼烧FeCl3溶液得到Fe2O3
难度: 中等查看答案及解析