-
升高温度时,化学反应速率加快,主要原因是
A. 分子运动速率加快,使该反应物分子的碰撞机会增多
B. 反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C. 该化学反应的过程是吸热的
D. 该化学反应的过程是放热的
难度: 中等查看答案及解析
-
下列有关热化学方程式及其叙述正确的是( )
A. H2的燃烧热为285.8 kJ/mol,则H2O分解的热化学方程式为:2H2O(l) = 2H2(g)+O2(g) ΔH=+285.8 kJ/mol
B. 1 mol CH4完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为:1/2CH4(g)+O2(g) = 1/2CO2(g)+H2O(l) ΔH=-445 kJ/mol
C. 已知2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ/mol,则C的燃烧热为110.5 kJ/mol
D. HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ/mol
难度: 中等查看答案及解析
-
改变下列条件,可以改变反应活化能的是
A、温度 B、催化剂 C、反应物浓度 D、压强
难度: 简单查看答案及解析
-
在密闭容器里,A与B反应生成C,其反应速率分别用
、
、
表示,已知2
=3
、3
=2
,则此反应可表示为
A. 2A+3B=2C B. A+3B=2C
C. 3A+B=2C D. A+B=C
难度: 中等查看答案及解析
-
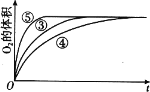
下列实验现象中,不能说明相应的化学反应是放热反应的是
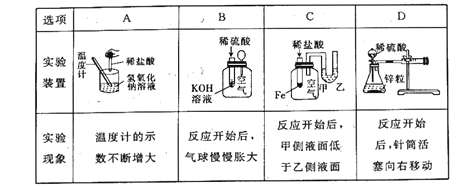
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下图表示可逆反应 mA(g)+nB(g)
pC(g)+qD(g) 在不同温度(T)和压强(P)下生成物D的体积分数w(D)随时间的变化情况。关于上述正反应的判断正确的是
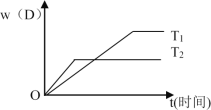
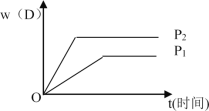
A. T1>T2 ,△H<0 B. T2>T1 ,△H>0
C. P2>P1 ,m+n>p+q D. P1>P2 ,m+n>p+q
难度: 中等查看答案及解析
-
20℃时,将10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/L的H2SO4溶液混合,2min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃,上述反应要看到同样的浑浊,需要的时间是
A. 48s B. 40s C. 20s D. 15s
难度: 简单查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应Cr2O72-+H2O⇌ 2CrO42-+2H+,当增加反应物浓度时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)⇌ 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A. ①④ B. ①②③ C. ②③④ D. ①②③④
难度: 中等查看答案及解析
-
1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)== b Z(g) 反应达到平衡后,测得X的转化率为50%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是 ( )
A. a=1 , b=1 B. a=2 , b=1 C. a=2 , b=2 D. a=3 , b=2
难度: 中等查看答案及解析
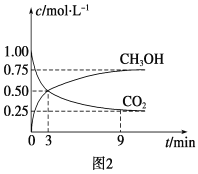
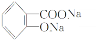
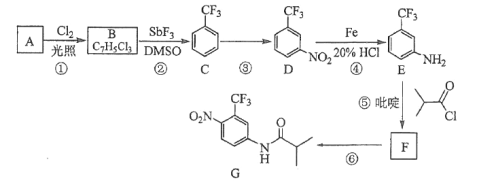
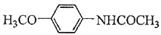 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(