-
已知
(l) H2 (g)+ 1/2 O2(g)=H2O(g) △H1=a kJ·mol-1
(2) 2H2(g)+O2(g)=2H2O(g) △H2=b kJ·mol-1
(3) H2 (g)+ 1/2 O2(g)=H2O(l) △H3=c kJ·mol-1
(4) 2H2(g)+O2(g) =2H2O(l) △H4=d kJ·mol-1
下列关系式中正确的是
A. a<c <0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
难度: 中等查看答案及解析
-
在气体反应中,改变条件:①增大反应物的浓度,②升高温度,③增大压强,④移去生成物,⑤加入催化剂。能使反应物中活化分子数和活化分子的百分数同时增大的方法是( )
A. ①⑤ B. ①③ C. ②⑤ D. ③⑤
难度: 中等查看答案及解析
-
0.3 mol的气态高能燃料乙硼烷B2H6在O2中燃烧,生成固态B2O3和液态H2O,同时放出649.5 kJ的热量。下列热化学方程式中正确的是
A. B2H6(g)+3O2(g)===B2O3(g)+3H2O(l) ΔH=+2165 kJ·mol-1
B. B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2165 kJ·mol-1
C. B2H6+3O2===B2O3+3H2O ΔH=-2165 kJ·mol-1
D. B2H6(g)+3O2(g)===B2O3(s)+3H2O(g) ΔH=-2165 kJ·mol-1
难度: 简单查看答案及解析
-
下列热化学方程式或离子方程式中,正确的是
A. 甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 氯化镁溶液与氨水反应:Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+
D. 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O===2Al(OH)3
难度: 中等查看答案及解析
-
分解1 g MgCO3可吸收1.366 kJ的热量,则MgCO3分解的热化学方程式中正确的是
A. MgCO3(s)===MgO(s)+CO2(g) ΔH=-1.366 kJ·mol-1
B. MgCO3(s)===MgO(s)+CO2(g) ΔH=+1.366 kJ·mol-1
C. MgCO3(s)===MgO(s)+CO2(g) ΔH=+114.7 kJ·mol-1
D. MgCO3(s)===MgO(s)+CO2(g) ΔH=-114.7 kJ·mol-1
难度: 简单查看答案及解析
-
已知2 L 0.5 mol/L H2SO4溶液与足量稀NaOH溶液反应,放出114.6 kJ的热量,表示该反应中和热的热化学方程式正确的是
A. H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l);ΔH=-114.6 kJ·mol-1
B. H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l);ΔH=+114.6 kJ·mol-1
C. 1/2H2SO4(aq)+NaOH(aq)==1/2Na2SO4(aq)+H2O(l);ΔH=+57.3 kJ·mol-1
D. 1/2H2SO4(aq)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l);ΔH=-57.3 kJ·mol-1
难度: 简单查看答案及解析
-
充分燃烧一定量的丁烷气体放出的热量为xQkJ,完全吸收它生成的CO2生成正盐,需5mol·L-1的KOH溶液100mL,则丁烷的燃烧热为( )
A. 16xQkJ·mol-1 B. 8xQkJ·mol-1 C. 4xQkJ·mol-1 D. 2xQkJ·mol-1
难度: 中等查看答案及解析
-
下列说法或表示法正确的是
A. 由“C(s,石墨)―→C(s,金刚石) ΔH=+119 kJ·mol-1”可知金刚石比石墨稳定
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l) ΔH=+285.8 kJ·mol-1
C. 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
D. 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
难度: 中等查看答案及解析
-
已知3.0 g乙烷完全燃烧在常温下放出的热量为155.98 kJ,则下列关于乙烷燃烧热的热化学方程式书写正确的是
A. 2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-3119.6 kJ/mol
B. C2H6(g)+5/2O2(g)===2CO(g)+3H2O(g) ΔH=-1559.8 kJ/mol
C. C2H6(g)+7/2O2(g)===2CO2(g)+3H2O(g) ΔH=-1559.8 kJ/mol
D. C2H6(g)+7/2O2(g)===2CO2(g)+3H2O(l) ΔH=-1559.8 kJ/mol
难度: 简单查看答案及解析
-
已知①2C(s)+O2(g)===2CO(g) ΔH1=-221.0 kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH2=-483.6 kJ·mol-1
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g),ΔH为
A. +262.6 kJ·mol-1 B. -131.3 kJ·mol-1
C. -352.3 kJ·mol-1 D. +131.3 kJ·mol-1
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体在2 L的定容密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)
2C(g);经2 s后测得C的物质的量浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的这段时间的平均速率为0.3 mol·L-1·s-1
②用物质B表示的这段时间的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为30%
④2 s时物质B的物质的量浓度为0.3 mol·L-1
其中正确的是( )
A. ①③ B. ②④ C. ①② D. ③④
难度: 简单查看答案及解析
-
如图小试管中盛有几毫升水,与大试管连通的U形细管内放有少量的水(已染成红色)。若沿小试管壁小心地慢慢注入3 mL浓硫酸,静置片刻后,U形细管中可观察到的液面现象是
A. 左高右低 B. 左低右高
C. 左右一样高 D. 来回振动
难度: 中等查看答案及解析
-
在可逆反应2A(g)+3B(g)
xC(g)+D(g)中,已知:起始浓度A为5 mol/L,B为3 mol/L,C的反应速率为0.5 mol/(L·min),2 min后,测得D的浓度为0.5 mol/L。则关于此反应的下列说法中正确的是
A. 2 min末时,A和B的浓度之比为5∶3 B. x=1
C. 2 min末时,B的浓度为1.5 mol/L D. 2 min末时,A的消耗浓度为0.5 mol/L
难度: 中等查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
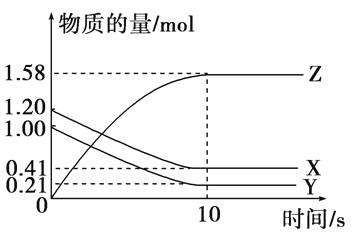
下列描述正确的是( )
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1
B. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C. 反应开始到10 s时,Y的转化率为79.0%
D. 反应的化学方程式为X(g)+Y(g)
Z(g)
难度: 中等查看答案及解析
-
将一定浓度的盐酸倒入盛有块状大理石的烧杯中,若进行如下改变,其中不能使最初的反应速率加快的是
A. 盐酸的浓度不变,其用量增加一倍 B. 盐酸的浓度增加一倍,其用量减少一半
C. 使反应在较高的温度下进行 D. 盐酸的浓度不变,使块状大理石变成粉末状
难度: 中等查看答案及解析
-
在一个定容的密闭容器中进行如下反应:2SO2(g)+O2(g)
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。当反应达平衡时不可能存在的数据正确的是
A. c(SO2)=0.25 mol·L-1 B. c(O2)=0.12 mol·L-1
C. c(SO2)+c(SO3)=0.15 mol·L-1 D. c(SO3)+c(O2)=0.3 mol·L-1
难度: 中等查看答案及解析
-
在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
难度: 简单查看答案及解析
-
下列说法可充分说明P(g)+Q(g) S(g)+R(g),在恒温下,恒容密闭容器中的反应已达平衡的是
A. 容器里P、Q、R、S四种物质共存 B. 容器里气体总物质的量不再改变
C. 容器内气体压强、密度不随时间变化 D. 单位时间内生成nmol P同时生成nmol S
难度: 中等查看答案及解析
-
下列说法中,正确的是
A. 在化学反应中发生物质变化的同时,不一定发生能量变化
B. ΔH>0表示放热反应,ΔH<0表示吸热反应
C. 放热反应,使体系的温度升高;吸热反应,使体系的温度降低
D. 生成物释放的总能量大于反应物吸收的总能量时,ΔH<0
难度: 简单查看答案及解析
-
以下反应中属于放热反应的是
A. 氢氧化钾与硝酸反应 B. 焦炭在高温下与水蒸气反应
C. 石灰石分解成氧化钙和二氧化碳 D. Ba(OH)2·8H2O与NH4Cl的反应
难度: 简单查看答案及解析
-
在2A+B
3C+4D中,表示该反应速率最快的是( )
A. υ(A) = 0.5mol·L-1·S-1 B. υ(B) =" 0.3" mol·L-1·S-1
C. υ(C) = 0.8mol·L-1·S-1 D. υ(D)=" 1" mol·L-1·S-1
难度: 中等查看答案及解析
-
在一定条件下的溶液中,反应FeCl3+3KSCN
Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡正向移动的是
A. 加水稀释 B. 加入少量FeCl3固体
C. 加入少量KCl溶液 D. 加入少量氢氧化钠固体
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法正确的是
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D. 催化剂能降低分子活化时所需能量,使单位体积内活化分子的百分数大大增加
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
难度: 简单查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
① C(s) + O2(g) = CO2(g) ;ΔH1 C(s) +
O2(g) = CO(g) ;ΔH2
② S(s) + O2(g) =SO2(g) ;ΔH3 S(g) + O2(g) = SO2(g) ;ΔH4
③ H2(g) +
O2(g) =H2O(l) ;ΔH5 2H2(g) + O2(g) = 2H2O(l) ;ΔH6
④ CaCO3(s) = CaO(s) + CO2(g) ;ΔH7 CaO(s) + H2O(l) = Ca(OH)2(s) ;ΔH8
A. ① B. ④ C. ②③④ D. ①②③
难度: 中等查看答案及解析