-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. pH=1的溶液中:Na+、K+、MnO4-、CO32-
B. c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3-
C. 0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl-
D. 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. 将铜丝插入稀硝酸中:Cu+4H++2NO3﹣═Cu2++2NO2↑+H2O
B. 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O
C. 向含1molFeBr2溶液中通入1mol Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-
D. 向碳酸钠溶液中加入足量醋酸溶液:CH3COOH+CO32-═CH3COO—+HCO3—
难度: 中等查看答案及解析
-
下列实验过程不可以达到实验目的的是()
编号
实验目的
实验过程
A
配制1.0 mol/L的NaOH溶液
称取4.0gNaOH固体置于100 mL容量瓶中,加入少量水溶解后定容
B
比较金属镁和铝的活泼性
分別向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象
C
比较Fe3+和I2的氧化性强弱
向淀粉碘化钾溶液中滴入氯化铁溶液,溶液变蓝色
D
探究浓度对反应速率的影响
向2支盛有5ml不同浓度稀硫酸溶液的试管中同时加入同样大小的锌粒,观察实验现象
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 反应 MgCl2(l)=Mg(l)+Cl2(g)的 △H<0、△S>0
B. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
C. 加热0.1 mol•L-1 CH3COOH溶液,CH3COOH的电离程度增大,溶液的pH减小
D. 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
难度: 中等查看答案及解析
-
常温下,Ka(HCOOH)=1.77xlO-4, Ka(CH3COOH)= Kb(NH3•H20)=1.75x 10-5,下列说法不正确的是()
A. 浓度均为0.1 mol•L-1 的HCOOH和NH3•H20溶液中:c(HCOO-)>c(NH4+)
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,HCOOH消耗NaOH溶液的体积比CH3COOH小
C. 0.1 mol• L-1CH3COOH溶液与0.1 mol• L-1NaOH溶液等体积混合后,溶液的pH=7
D. pH=7的HCOOH和NH3•H20的混合溶液中,c(HCOO—)=c(NH4+)
难度: 中等查看答案及解析
-
在25℃时,用蒸馏水稀释l mol• L-1氨水至0.01 mol• L-1,随溶液的稀释,下列各项中始终保持增大趋势的是()
A. c(OH-) B. c(NH4+)/c(OH-) C. c(NH3•H20)/c(NH4+) D. c(OH-)/c(NH3•H20)
难度: 中等查看答案及解析
-
下列过程不属于放热反应的是( )
A. 木材燃烧
B. N2(g)+3H2(g)
2NH3(g)
C. H20(g)=H20(l)
D. 盐酸和氢氧化钠反应
难度: 简单查看答案及解析
-
在其他条件相同时,反应N2+02=2NO分别在有、无催化剂时的能量变化如下图所示,下列说法中不正确的是( )
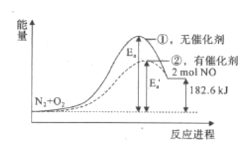
A. 该反应中反应物的总能量比生成物的总能量低
B. 加入催化剂能改变反应的焓变
C. 加入催化剂可以改变反应的活化能
D. 0.2 mol NO完全分解成N2和02时共放出热量18.26 kJ
难度: 简单查看答案及解析
-
已知反应CH4(g)+CO2(g)
2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
A. 高温低压 B. 低温高压 C. 高温高压 D. 低温低压
难度: 简单查看答案及解析
-
反应2SO2(g) + O2(g)
2SO3(g) △H =-akJ/mol(a>0),能量变化如图所示,下列说法不正确的是

A. 2SO2(g) +O2(g)
2SO3(1) △H>-a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molS02(g)和1 mol 02(g)置于一密闭容器中充分反应后放出的热量小于a kJ
难度: 中等查看答案及解析
-
K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
难度: 中等查看答案及解析
-
用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g)
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
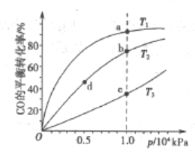
A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
难度: 困难查看答案及解析
-
在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g)
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
10
12
n(Y)/mol
1.40
1.10
0.40
0.40
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol• L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
难度: 中等查看答案及解析
-
某密闭容器中发生如下反应:2X(g)+Y(g)
2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是( )
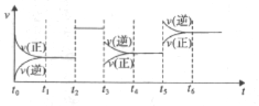
A. t3时降低了温度 B. t5时增大了压强
C. t6时刻后反应物的转化率最低 D. t4时该反应的平衡常数小于t6时反应的平衡常数
难度: 中等查看答案及解析
-
汽车尾气净化中的一个反应如下:NO(g)+CO(g)
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 困难查看答案及解析
-
向lOmL 1 mol• L-1的HCOOH溶液中不断滴加1 mol• L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc(H+)的关系如图所示。c(H+)为溶液中水电离出的c(H+)。下列说法正确的是()

A. HCOOH为强电解质
B. a、b两点pH均为7
C. 混合溶液的pH逐渐增大
D. 从a点到b点,溶液的导电性先增强后减弱
难度: 中等查看答案及解析
