-
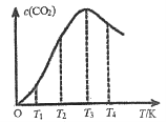
一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s)⇋CaO(s)+CO2(g)达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达平衡时,CO2浓度为原来的2倍
B. 增加CaCO3(s)的量,平衡正向移动,CO2的浓度增大
C. 将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D. 保持容器体积不变,充入He,平衡向逆反应方向进行
难度: 中等查看答案及解析
-
下列有关电解质的说法正确的是
A. 强电解质一定是离子化合物
B. 强电解质溶液的导电能力一定比弱电解质强
C. 易溶性强电解质的稀溶液中不存在溶质分子
D. 由于硫酸钡难溶于水,所以硫酸钡是弱电解质
难度: 简单查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
难度: 困难查看答案及解析
-
下列说法不正确的是
A. 在其他外界条件不变的情况下,增大压强,不能增大活化分子的百分数
B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D. ΔH<0、ΔS>0的反应在任何温度下都能自发进行
难度: 困难查看答案及解析
-
取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为
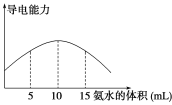
A. 0.5% B. 1.5% C. 0.1% D. 1%
难度: 中等查看答案及解析
-
在一定条件下,体积不变的密闭容器中,发生可逆反应2SO2(g)+O2(g)
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
A. 增大压强,平衡正向移动,此反应的ΔH仍保持不变
B. 增大O2浓度,SO2的平衡转化率减小
C. 降低温度,化学平衡常数减小
D. 升高温度,SO2的转化率一定增大
难度: 困难查看答案及解析
-
2NO2(红棕色)
N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
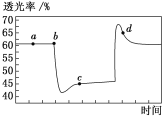
A. b点达到了平衡状态
B. b点对应的时刻改变的条件是将注射器的活塞向外拉
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
难度: 困难查看答案及解析
-
下列关于常温下pH=2的醋酸溶液的叙述正确的是
A. c(CH3COOH)=0.01 mol·L-1
B. c(H+)=c(CH3COO-)
C. 加水稀释100倍后,pH=4
D. 加入醋酸钠固体,可抑制醋酸的电离
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-。下列叙述正确的是
A. 将纯水加热到95 ℃时,Kw变大,pH不变,水仍呈中性
B. 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C. 向纯水中加入少量固体碳酸钠,c(H+)减小,Kw不变,促进水的电离
D. 向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变
难度: 中等查看答案及解析
-
下列生产或实验事实引出的相应结论不正确的是( )
选项
事实
结论
A
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短
当其他条件不变时,升高反应温度,化学反应速率加快
B
工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环
增大气液接触面积,使SO3的吸收速率增大
C
在容积可变的密闭容器中发生反应:2NH3(g)
N2H4(l)+H2(g),把容积的体积缩小一半
正反应速率加快,逆反应速率减慢
D
A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快
当其他条件不变时,催化剂可以改变化学反应速率
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
难度: 困难查看答案及解析
-
MOH和ROH两种一元碱,其水溶液分别加水稀释时,pH变化如图所示。下列叙述正确的是
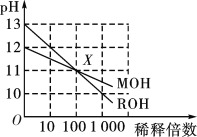
A. 在X点时,ROH完全电离
B. 在X点时,c(M+)>c(R+)
C. MOH是一种强碱
D. 稀释前,c(ROH)=10c(MOH)
难度: 中等查看答案及解析
-
向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g)
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
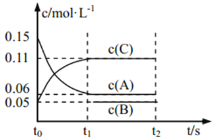
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡,A的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段,此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)
B(g)+2C(g) ΔH=-50a kJ·mol-1
难度: 困难查看答案及解析
-
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
难度: 中等查看答案及解析
-
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是
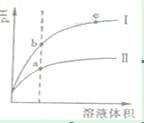
A. Ⅱ为盐酸稀释时pH值变化曲线 B. b点溶液的导电性比c点溶液的导电性强 C. a点Ka的数值比c点Ku的数值大 D. b点酸的总浓度大于a点酸的总浓度
难度: 中等查看答案及解析
-
硫酸工业生产过程中,涉及SO2转化为SO3的反应,某化学研究小组在450 ℃时,在一容积为10 L 的恒容密闭容器中研究该可逆反应:2SO2(g)+O2(g)
2SO3(g),得出的相关数据如表所示:
时间/min
n(SO2)/mol
n(O2)/mol
n(SO3)/mol
0
0.200
0.100
0
10
0.190
0.095
0.010
15
0.160
0.080
0.040
20
0.160
0.080
0.040
25
0.150
0.150
0.050
根据表中数据,下列判断正确的是
A. 0~10 min内的反应速率可表示为v(SO2)=0.010 mol/(L·min)
B. 15~20 min内,正、逆反应速率不相等
C. 工业上常用增加SO2的量来提高O2的转化率
D. 20~25 min内,数据变化的原因可能是增加了O2的物质的量
难度: 中等查看答案及解析
-
已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO42-。某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述不正确的是
A. 该温度高于25℃
B. 由水电离出来的H+的浓度为1×10-10 mol·L-1
C. 加入NaHSO4晶体抑制了水的电离
D. 取该溶液加水稀释100倍,溶液中的c(OH-)减小
难度: 中等查看答案及解析
-
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
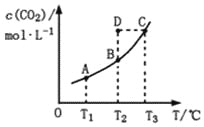
A. 反应CO(g)+H2O(g)
CO2(g)+H2(g)的ΔH>0
B. 在T2时,若反应处于状态D,则一定有ν正<ν逆
C. 平衡状态A与C相比,平衡状态A的c(CO)小
D. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2
难度: 困难查看答案及解析
-
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃
15.0
20.0
25.0
30.0
35.0
平衡总压强/kPa
5.7
8.3
12.0
17.1
24.0
平衡气体总浓度/10-3 mol·L-1
2.4
3.4
4.8
6.8
9.4
A. 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B. 因该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在低温下自发进行
C. 根据表中数据,计算15.0 ℃时的分解平衡常数约为2.0×10-9
D. 达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
难度: 中等查看答案及解析
-
在2L密闭容器中进行反应C(s)+H2O(g)
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
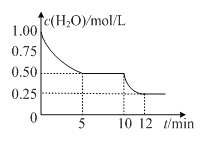
A. 5min时该反应的K值一定小于12 min时的K值
B. 0~5min内,v (H2)=0.05mol/(L•min)
C. 10 min时,改变的外界条件可能是减小压强
D. 该反应混合气体的平均相对分子质量:5min时小于12 min 时的
难度: 困难查看答案及解析
-
水的电离平衡曲线如图所示,下列说法不正确的是
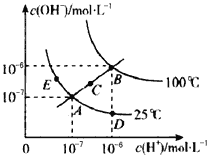
A. 图中五点Kw间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量酸的方法
C. 若从A点到C点,在温度不变时向水中加入适量NH4Cl固体
D. 若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
难度: 中等查看答案及解析
-
在1 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
M(g)+N(g),所得实验数据如下表:
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.10
0.10
0.09
②
800
0.20
0.20
0.10
③
800
0.20
0. 30
a
④
900
0.10
0.15
b
下列说法错误的是( )
A. 实验①中,若5 min时测得n(M) =0.05 mol,则0至5 min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K=1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06
难度: 困难查看答案及解析
-
合成氨的热化学方程式为:N2(g)+3H2(g)
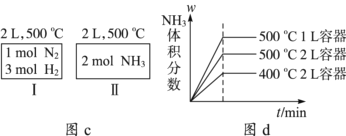
2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
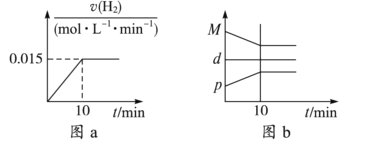
A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示
B. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者的变化趋势如图b
C. 如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2、3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
难度: 中等查看答案及解析