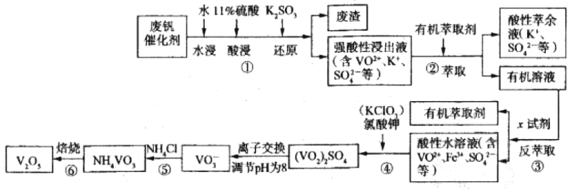
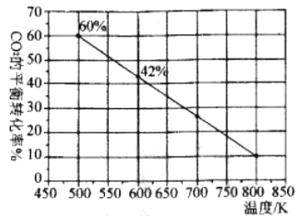
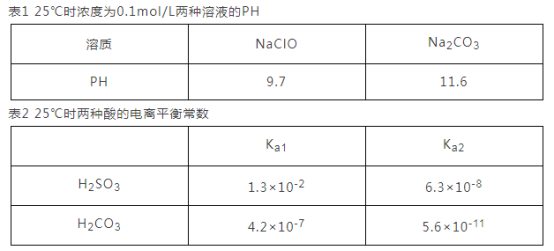
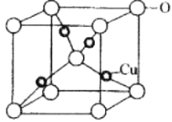
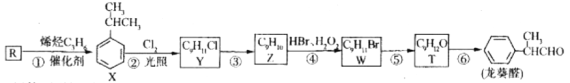
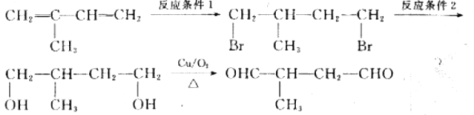
-
化学与人类生产、生活密切相关。下列叙述正确的是
A. 熟石灰可作食品干燥剂
B. SO2具有漂白性,可用作食品漂白剂
C. 氢氧化铝、碳酸钠都是常见的胃酸中和剂
D. 硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 14gC2H4含有的单键数目为3NA
B. 99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C. 足量的Na与1molO2充分反应,转移的电子数目一定为2NA
D. 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA
难度: 中等查看答案及解析
-
芳香化合物C9H10O2能与 NaHCO3溶液反应生成CO2,其可能的结构共有(不含立体异构)
A. 11种 B. 12种 C. 13种 D. 14种
难度: 中等查看答案及解析
-
一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是
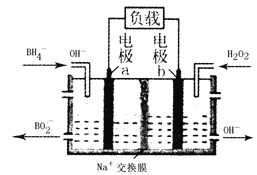
A. 电池的正极反应为H2O2+2e-==2OH-
B. 电池放电时Na+从a极区移向b极区
C. 电子从电极b经外电路流向电极a
D. b极室的输出液经处理后可输入a极室循环利用
难度: 中等查看答案及解析
-
下列实验的实验操作、实验现象和实验结论都正确的是
选项
实验操作
实验现象
实验结论
A
室温下,向铝箔上滴加浓硫酸
无明显现象
铝与浓硫酸不反应
B
将二氧化硫通入紫色石蕊试液
先变红后褪色
二氧化硫是酸性氧化物,还具有漂白性
C
在氯化银悬浊液中滴加少量KBr稀溶液
白色浑浊变为淡黄色浑浊
Ksp(AgCl)>Ksp (AgBr)
D
NaAlO2溶液中滴加 NaHCO3溶液
产生白色沉淀
N aAlO2和Na HCO3发生相互促进的水解反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有9个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A. 原子半径:W<X<Y<Z
B. 化合物Y2Z中既有离子键、又有共价键
C. Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
D. 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
难度: 中等查看答案及解析
-
下列各项关系中正确的是( )
A. 0.1mol/LNa2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)=0.2mol/L
B. 常温下pH=a的稀H2SO4与pH=b的氨水等体积混合后恰好完全反应,则a+b<14
C. 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D. pH相同的三种溶液①NH4Cl ②(NH4)2SO4 ③NH4HSO4,c(NH4+)大小关系为:①>②>③
难度: 困难查看答案及解析