-
化学物质对应的性质表现各异,下列说法不正确的是( )
A. 浓硫酸不能与金、铂反应,而王水能使金、铂溶解
B. 大气中的飘尘可利用胶体粒子的带电性加以清除
C. 氧化膜使得性质活泼的金属铝成为一种应用广泛的金属材料
D. 冶炼钛要在高温下进行,则高温下的钛不活泼
难度: 中等查看答案及解析
-
下列事实描述中对应的离子方程式书写正确的是( )
A. SO2通入漂白粉溶液中产生白色沉淀:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
B. 少量Cl2通入到FeBr2溶液中:Cl2+2Br-=2Cl-+Br2
C. 往KHCO3溶液中加少量Ba(OH)2溶液产生白色沉淀:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
D. 用氨水和饱和FeCI3溶液制备胶体:3NH3ˑH2O+Fe3+=Fe(OH)3(胶体)+3NH4+
难度: 中等查看答案及解析
-
丰富多彩的有机物存在许多性质的差异,下列描述正确的是( )
A. 聚氯乙烯能使溴水褪色
B. 淀粉和纤维素都是能发生水解反应的高分子化合物
C. 分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸
D. 苯酚在空气中变成粉红色,说明苯酚具有酸性
难度: 中等查看答案及解析
-
短周期主族元素中X、Y、Z、W的原子序数依次增加,X与Y组成的气态氢化物可使湿润的红色石蕊试纸变蓝,由Z组成的物质的焰色皆为黄色,Z与W组成的物质的水溶液显中性,下列说法正确的是( )
A. 原子半径:W>Z>Y>X
B. Z与氧元素形成的化合物中都只含离子键
C. 气态氢化物的稳定性:W>Y
D. 由Y组成的含氧酸皆为强酸
难度: 中等查看答案及解析
-
实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
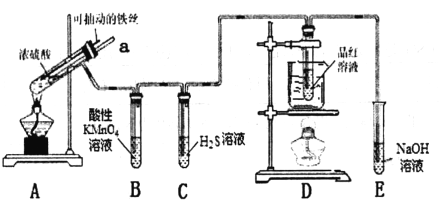
A. 装置C中产生淡黄色的沉淀,体现了SO2的氧化性
B. 装置E的作用是吸收未反应的SO2,防止污染空气
C. 装置D中品红溶液褪色后加热又变红色,可验证SO2溶于水显酸性
D. 实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
难度: 中等查看答案及解析
-
化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示。下列说法不正确的是( )
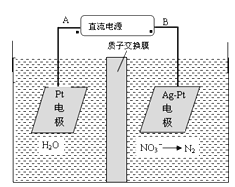
A. 电解过程中,每转移1mol电子,则左侧电极就产生16g O2
B. 溶液中H+从阳极向阴极迁移
C. Ag-Pt电极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
D. B为电源的负极
难度: 中等查看答案及解析
-
25 ℃时,用0.10 mol·L-1的氨水滴定10.00 mL a mol·L-1的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。已知N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法不正确的是( )
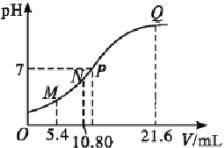
A. 图上四点分子种类相同
B. a=0.1
C. N、Q两点的
:N=Q
D. P点溶液中存在:c(Cl-)=c(NH4+)
难度: 困难查看答案及解析
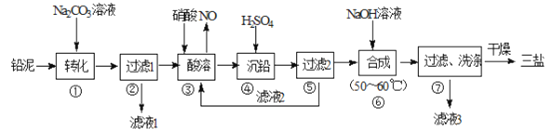

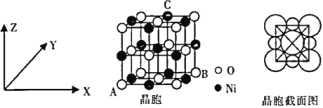
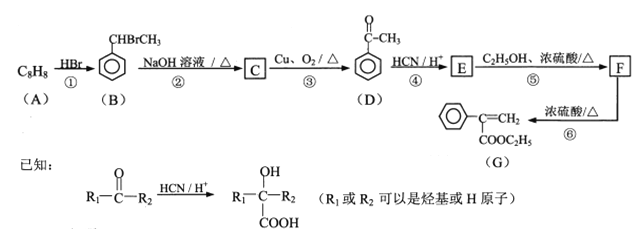
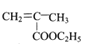 的路线流程图_______________。
的路线流程图_______________。