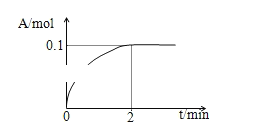
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使产生氢气的速率加快的是( )
A. 加热 B. 不用稀硫酸,改用98%浓硫酸
C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉
难度: 中等查看答案及解析
-
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+ 则A、B、D、E金属性由强到弱的顺序为( )
A. A﹥B﹥E﹥D B. A﹥B﹥D﹥E C. D﹥A﹥B﹥E D. D﹥E﹥A﹥B
难度: 中等查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
难度: 简单查看答案及解析
-
下列有关金属腐蚀与保护的说法正确的是
A.钢铁在潮湿空气中发生吸氧腐蚀,负极反应为Fe-3e-===Fe3+
B.相同条件下,轮船在海水中比在淡水中腐蚀慢
C.铁上镀锌的保护方法叫牺牲负极的正极保护法
D.水库里钢闸门与电源负极相连的方法叫做外加电流的阴极保护法
难度: 中等查看答案及解析
-
为了除去氯化镁酸性溶液中的Fe3+,可在加热搅拌条件下加入下列试剂中的( )
A. NH3·H2O B. NaOH C. Na2CO3 D. MgCO3
难度: 简单查看答案及解析
-
从如图所示的某气体反应的能量变化分析,以下判断错误的是 ( )

A. 这是一个放热反应 B. 该反应可能需要加热
C. 生成物的总能量低于反应物的总能量 D. 反应物比生成物更稳定
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B. 向氯水中加CaCO3后,溶液漂白性增强
C. 用排饱和食盐水法收集氯气
D. 开启啤酒瓶后,瓶中立刻泛起大量泡沫
难度: 中等查看答案及解析
-
已知反应mX(g)+nY(g)⇌qZ(g),△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列有关说法正确的是( )
A. 如果继续通入一定量某气体使体系压强增大,平衡将正向移动
B. 此时,X的正反应速率是Y的逆反应速率的π/n倍
C. 如果降低温度,且保持物质状态不发生改变,混合气体的平均相对分子质量变小
D. 如果增加X的物质的量,平衡正向移动,X的转化率增大
难度: 中等查看答案及解析
-
对pH值相同的盐酸和醋酸两种溶液的说法正确的是
A. 中和碱的能力相同 B. 盐酸和醋酸的物质的量浓度相同
C. OH-的物质的量浓度相同 D. H+的物质的量浓度不同
难度: 中等查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的
A.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失
B.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定
C.滴定过程中,锥形瓶中有溶液溅出
D.酸式滴定管未用标准盐酸润洗
难度: 中等查看答案及解析
-
常温下,下列溶液中各组离子一定能大量共存的是( )
A. 使甲基橙呈红色的溶液中:Na+、[Al(OH)4]﹣、NO3﹣、CO32﹣
B. 由水电离产生的c(H+)=10﹣12mol·L﹣1的溶液:NH4+、SO42﹣、HCO3﹣、Cl﹣
C. 含有0.1 molL﹣1 HCO3﹣的溶液:Na+、Fe3+、NO3﹣、SCN﹣
D. Kw/c(H+) =0.1 molL﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
难度: 中等查看答案及解析
-
在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是
A. v(N2)=0.05mol·L-1·s-1 B. v(H2)=0.3mol·L-1·min-1
C. v(N2)="0.2" mol·L-1·min-1 D. v(NH3)="0.3" mol·L-1·min-1
难度: 中等查看答案及解析
-
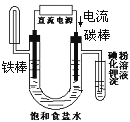
关于下列各装置图的叙述中,不正确的是( )
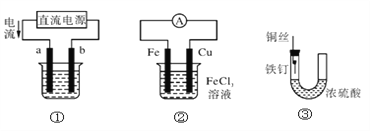
A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 用装置①进行电镀,镀件接在b极上
C. 装置②的总反应是:Cu+2Fe3+===Cu2++2Fe2+
D. 装置③中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)⇌CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A. MnS的
比CuS的
大
B. 该反应达到平衡时:
C. 往平衡体系中加入少量
固体后,
变大
D.
的浊液中加入少量可溶性
固体后,
变大
难度: 中等查看答案及解析
-
已知水的电离方程式:H2O
H+ + OH-,下列叙述中正确的是
A. 升高温度,KW增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,KW不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列化学用语中正确的是( )
A. 氢氧燃料电池在碱性介质中负极的反应式是:O2+2H2O+4e- = 4OH-
B. NaHCO3在水溶液中的水解离子方程式:HCO3-+H2O
CO2↑+ OH-
C. 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
D. 钢铁发生电化学腐蚀的正极反应式:Fe-2 e- = Fe2+
难度: 中等查看答案及解析
-
反应X(g)+3Y(g)
2Z(g);ΔH<0 在不同温度、不同压强(P1>P2)下,达到平衡时,混合气体中Z的体积分数φ(Z)随温度变化的曲线应为

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下面有关电化学的图示,完全正确的是
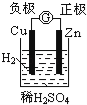
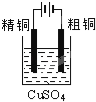
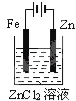
A. Cu﹣Zn原电池
B. 粗铜的精炼
C. 铁片镀锌
D. 验证NaCl溶液(含酚酞)电解产物
难度: 中等查看答案及解析
-
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)
2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物的量浓度、反应速率分别随时间的变化如下图所示:
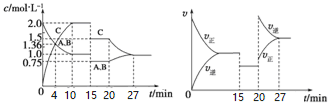
下列说法中正确的是
A. 4 min时反应第一次达到平衡
B. 15 min时降低压强,20 min时升高温度
C. 反应方程式中的x=1,正反应为吸热反应
D. 15~20 min该反应使用了催化剂
难度: 困难查看答案及解析
-
工业上处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和CO2,已知:CO(g)+1/2O2(g)═CO2(g)△H=﹣283.0kJ•mol﹣1 S(s)+O2(g)═SO2(g)△H=﹣296.0kJ•mol﹣1此反应的热化学方程式是( )
A. CO(g)+1/2SO2(g)═1/2S(s)+CO2(g)△H=+135kJ/mol
B. CO(g)+1/2SO2(g)═1/2S(s)+CO2(g)△H=+13kJ/mol
C. 2CO(g)+SO2(g)═S(s)+2CO2(g)△H=﹣582kJ/mol
D. 2CO(g)+SO2(g)═S(s)+2CO2(g)△H=﹣270kJ/mol
难度: 中等查看答案及解析