-
化学与生活密切相关。下列说法正确的是:
A. 碳酸钠属于酸碱盐中的碱,可作食用碱
B. 可用浸泡过高锰酸钾溶液的硅土保鲜水果
C. 铝的利用较铁晚,是因铝在自然界中的含量少
D. 过氧化钠属于碱性氧化物,可作供氧剂
难度: 中等查看答案及解析
-
下列实验操作或仪器的选择正确的是:
A. 用玻璃棒蘸某溶液在酒精灯上灼烧,检验溶液中是否含有Na+
B. 用容量瓶配溶液时,若加水超过刻度线,应用滴管吸出多余液体
C. 配制480 mL一定物质的量浓度溶液时,应选用500 mL的容量瓶
D. 量取7.20 mL溶液,可选用10 mL的量筒
难度: 中等查看答案及解析
-
已知:①
②
③
的分子式均为C8H8,下列说法正确的是:
A. ①的三氯代物与五氯代物的同分异构体数目相同
B. ①②③均能使溴的四氯化碳溶液褪色
C. ②分子中所有原子一定在同一平面内
D. 仅从碳的四价考虑,①的同分异构体只有②和③
难度: 困难查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是:
A. 1L0.5mol/L碳酸钠溶液中含有的CO32-离子数为0.5NA
B. 5.6gFe与稀硝酸完全反应,转移的电子数可能为0.2NA
C. 3.2g甲醇中的羟基所含电子数为NA
D. 2molNO与1molO2充分反应,产物分子数为2NA
难度: 中等查看答案及解析
-
下列判断正确的是:
A. NaHCO3溶液中滴加少量Ba(OH)2溶液反应的离子方程式为:HCO3-+OH-+Ba2+==BaCO3↓+H2O
B. 钠与水反应的离子方程式为:Na+H2O===Na++OH-+H2↑
C. HS-的电离方程式为:HS-+H2O
H2S+OH-
D. c(H+)=1.0mol/L的溶液中Na+、Al3+、NO
、I-不能大量共存
难度: 中等查看答案及解析
-
某充电电池以K2FeO4和Zn为电极材料,电解质是KOH,放电时Zn转化为Zn(OH)2、FeO42-转化为Fe(OH)3,下列说法正确的是:
A. 正极FeO42−失电子发生还原反应
B. Zn为电池的负极,电子经KOH溶液流入正极
C. 该电池充电过程中Zn极发生氧化反应
D. 该电池放电时OH-向Zn电极迁移
难度: 困难查看答案及解析
-
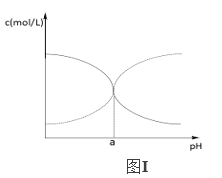
在一定体积的含有Al3+、Mg2+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应,假设Al3+、Mg2+结合OH-的能力相同),产生沉淀的物质的量与所加溶液的体积的关系如图所示。下列说法正确的是:
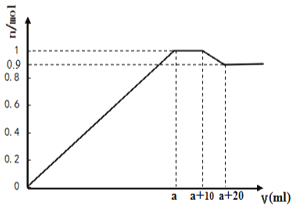
A. 当a<V<a+10时,不再生成难溶物
B. 上述含Al3+、Mg2+、Ba2+的混合溶液中3c(Al3+)+2c(Mg2+)=c(Ba2+)
C. 上述含Al3+、Mg2+、Ba2+的混合溶液中n(Al3+) = 0.2mol
D. NaOH和Na2SO4的混合溶液中c(NaOH)>c(Na2SO4)
难度: 困难查看答案及解析