-
某原电池以银、铂为电极,用含Ag+的固体作电解质,Ag+可在固体电解质中自由移动。电池反应为2Ag+Cl2=2AgCl。利用该电池可以测定空气中Cl2的含量。下列说法错误的是
A. 空气中c(Cl2)越大,消耗Ag的速率越大
B. 电子移动方向:银→固体电解质→铂
C. 电池工作时电解质中Ag+总数保持不变
D. 铂极的电极反应式为Cl2+2e-+2Ag+=2AgCl
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B. 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C. pH=12的溶液:K+、Na+、CH3COO-、Br-
D. 25℃时,由水电离产生的c(H+)为 1
10-9的溶液中:Mg2+、Cu2+、SO32-、NO3-
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 催化剂能增大活化分子的百分数,从而成倍地增大反应速率
B. 恒压容器中发生反应N2+O2
2NO,若在容器中充入He,正逆反应的速率均不变
C. 当一定量的锌粉和过量的6 mol·L-1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入一些水、CH3COONa溶液或NaNO3溶液
D. 已知t1 ℃时,反应C+CO2
2CO ΔH>0的速率为v,若升高温度正反应速率减小
难度: 中等查看答案及解析
-
分析下列反应在任何温度下均能自发进行的是(
A. 2N2(g)+O2(g)=2N2O(g) △H = +163 kJ•mol-1
B. H2O2(l)=1/2O2(g)+H2O(l) △H =-98 kJ•mol-1
C. HgO(s)=Hg(l)+1/2O2(g) △H =+91 kJ•mol-1
D. Ag(s)+1/2Cl2(g)=AgCl(s) △H =-127 kJ•mol-1
难度: 中等查看答案及解析
-
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O
KIO3+3H2↑.下列有关说法正确的是( )
A. 电解时,石墨作阴极,不锈钢作阳极 B. 电解时阳极反应是:I﹣﹣6e﹣+3H2O=IO3﹣+6H+
C. 溶液调节至强酸性,对生产有利 D. 电解后溶液的pH增大
难度: 中等查看答案及解析
-
常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A. 同物质的量浓度的三种溶液的pH:a=b>c
B. 同pH时,三种溶液稀释相同倍数后,pH:a=b<c
C. 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c
D. 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
难度: 简单查看答案及解析
-
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。
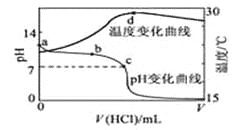
下列有关说法正确的是
A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)= c(NH4+)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. Na2CO3溶液中c(Na+)与c(CO32-)之比大于2:1
B. 蒸发氯化铝溶液要不断通入氯化氢气体方可得到氯化铝晶体
C. 1 L 0.3 mol/L醋酸溶液中H+个数与3 L 0.1 mol/L醋酸溶液中H+个数之比为1:1
D. 0.1 mol·L-1 Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HSO3-)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 常温下将等体积pH =3的H2SO4和pH =11的碱BOH溶液混合,所得溶液不可能为酸性
B. NaHCO3溶液中:c(HCO3-)+c(H2CO3)+2c(CO32-)=c(Na+)
C. 常温下将0.1mol/L的HI溶液加水稀释100倍,溶液中所有离子的浓度随之减小
D. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,各溶液浓度大小顺序:③>②>①
难度: 中等查看答案及解析
-
反应A+B→C分两步进行:①A+B→X ②X→C,反应过程中能量变化如图所示,下列有关叙述正确的是
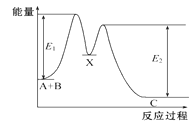
A. E2表示反应X→C的活化能 B. X是反应A+B→C的催化剂
C. 反应A+B→C的ΔH<0 D. 加入催化剂可改变反应A+B→C的焓变
难度: 简单查看答案及解析
-
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是
A. 密闭容器中二氧化碳的体积分数不变 B. 密闭容器中气体的总物质的量改变
C. 密闭容器中混合气体的密度不变 D. 2v正(NH3)=v逆(CO2)
难度: 简单查看答案及解析
-
25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为
A. 1.8×10-7mol/L B. 1.8×10-8 mol/L
C. 1.8×10-9mol/L D. 1.8×10-10mol/L
难度: 中等查看答案及解析
-
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+==Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
A. 该装置可能是原电池,也可能是电解池
B. 该装置只能是电解池,且金属铜为该电解池的阳极
C. 该装置只能是原电池,且电解质溶液为硝酸
D. 该装置只能是原电池,电解质溶液不可能是盐酸
难度: 简单查看答案及解析
-
已知:2CH3OH(g)
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol。某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质
CH3OH
CH3OCH3
H2O
c/(mol·L-1)
0.8
1.24
1.24
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减小20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A. ①②④⑤ B. ②⑥ C. ②③④⑥ D. ②④⑥
难度: 困难查看答案及解析
-
已知反应FeCl3+3KSCN
Fe(SCN)3+3KCl,下列条件改变能导致平衡逆向移动的是
①加入KCl固体 ②加入KCl溶液 ③加入FeCl3固体 ④加入KI固体 ⑤加压
A.①④ B.①② C.③⑤ D.②④
难度: 中等查看答案及解析
-
与纯水的电离相似,液氨中也存在着微弱的电离:2NH3
NH4++ NH2-,据此判断以下叙述中错误的是( )
A. 液氨中含有NH3、NH4+、NH2-等微粒
B. 一定温度下,液氨中c(NH4+)·c(NH2-)是个常数
C. 液氨的电离达到平衡时:c(NH3)=c(NH4+)=c(NH2-)
D. 只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
难度: 中等查看答案及解析