-
I.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为______________________________________。
(2)在该条件下,反应前后容器的体积之比为______________。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)______0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量_______Q kJ(填 “大于”、“小于”或“等于”)。
II. 用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
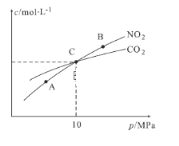
(1)A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B) (填 “﹥”、“<”或“﹦”)。
(2)A、B、C三点中NO2的转化率最高的是_____(填“A”或“B”或“C”)点。
(3)计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
-
I.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为______________________________________。
(2)在该条件下,反应前后容器的体积之比为______________。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)______0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量_______Q kJ(填 “大于”、“小于”或“等于”)。
II. 用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
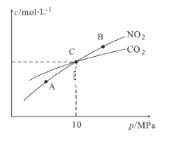
(1)A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B) (填 “﹥”、“<”或“﹦”)。
(2)A、B、C三点中NO2的转化率最高的是_____(填“A”或“B”或“C”)点。
(3)计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生反应2SO2(g)+O2(g)  2SO3(g) ΔH<0。2 mi
2SO3(g) ΔH<0。2 mi n后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
n后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在恒温恒压下,向密闭容器中充入4mol SO2和2mol O2,发生反应2SO2(g)+O2(g) 2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2L,则v(SO3)=0.35mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2.0 L的密闭容器中发生反应:2SO2 + O2 2SO3,经过2.0 min达到平衡状态,SO2的平衡转化率为90.0%。
2SO3,经过2.0 min达到平衡状态,SO2的平衡转化率为90.0%。
(1)0~2 min内O2的平均反应速率v(O2)=_______________。
(2)该温度下此反应的化学平衡常数K=________________。
(3)在相同的温度下,某容器内c(SO2)=c(O2)=c(SO3)=1.0 mol•L-1,则此时反应速率v正________v逆(填“>”、“<”或“=”)。
-
I.(化学反应原理)
恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应到平衡状态,生成C的平均反应速率为___。
(2)该反应的化学平衡表达式为___。
(3)下列各项可作为该反应达到平衡状态的标志是___。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.A的消耗速率与B的消耗速率之比为2:1
II.(化学与生活)
有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是___(填序号)。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是___(填序号)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是___(填序号)。
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

