-
在恒温恒压下,向体积为2 L密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0。2min后,反应达到平衡,生成SO3为2mol。
求:(1)0~2 min内v(SO3)______________?
(2)平衡后容器中SO2的浓度_____________?
(3)在此温度下该反应的平衡常数______________?
-
恒温下,将a mol O2与bmol SO2的混合气体通入一个固定容积的密闭容器中,发生如下反应:O2(g) + 2SO2(g) 2SO3(g)
2SO3(g)
(一)①若反应达平衡时,n(O2) = 4mol,n(SO3) = 4mol,计算a的值为____。
②平衡时总体积在标准状况为313.6L,原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) =____。
③达到平衡时,O2和SO2的转化率之比,α(O2)∶α (SO2)=____。
(二)若起始将6mol O2、b mol SO2和1 molSO3通入上反应容器中,起始反应向正方向进行,使反应达到平衡时容器中气体的物质的量为12mol。则b的取值范围是____。
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
(12分)恒温下,将a mol O2与bmol SO2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
O2 (g) + 2SO2(g) 2SO3(g)
2SO3(g)
(一)①若反应达平衡时,n (O2) = 4mol,n(SO3) = 4mol,计算a的值为 。
②平衡时总体积在标准状况为313.6L,原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
③达到平衡时,O2和SO2的转化率之比,α(O2)∶α (SO2)= 。
(二)若起始将6mol O2、b mol SO2和1 molSO3通入上反应容器中,起始反应向正方向进行,使反应达到平衡时容器中气体的物质的量为12mol。则b的取值范围是 。
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。2 min后生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) ΔH<0。2 min后生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L·min)
C.在该条件下充入He气,各物质的反应速率都将增大
D.若反应改为“恒温恒容下”进行,放出Q kJ热量需要的时间将大于2 min
-
在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2SO2(g)+O2(g)
 2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molSO21molO2 | 2molSO3 | 4molSO22molO2 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(1)若初始投入amolSO2、bmolO2和cmolSO3,在相同条件下,要达到与甲相同的化学平衡,则a、c与b、c间应满足的代数关系式为________、________.
(2)该温度下此反应的平衡常数值为________,若在相同温度条件下起始投入0.1molSO2、0.1molO2、0.3molSO3,则反应开始时正逆反应速率的大小关系是V正________V 逆
(3)三个容器中的反应分别达平衡时各组数据关系正确的是________
A.α1+α2=1 B.Q1+Q2=196 C.α3<α1
D.P3<2P1=2P2E.n2<n3<3.2mol F.Q3=2Q1
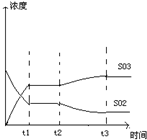
(4)如图表示甲反应在t1时刻达到化学平衡,在t2时刻因改变某个条件而发生变化的情况,则t2时刻改变的条件可能是________或________.
-
在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是
2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)>1.4mol
C. 若反应开始时容器容积为2L,则v(SO3)=0.35mol·L-1·min-1
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量小于Q kJ
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
