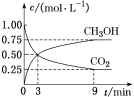
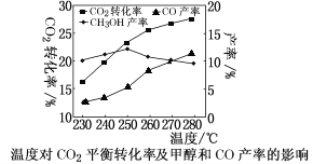
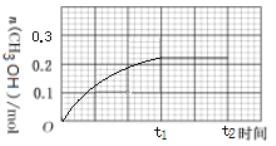
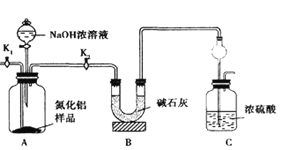
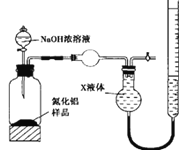
-
下列说法不正确的是
A. 二氧化氮会导致酸雨和光化学烟雾,危害较大
B. 铝的氧化物熔点高,常用于制造耐火材料
C. 人体中极少量的NO会促进血管扩张,可防止血管栓塞
D. Al(OH)3胶体能凝聚水中的悬浮物并使之沉降,因此明矾常用于自来水消毒剂
难度: 简单查看答案及解析
-
已知pOH=-lgc(OH-),下列溶液中一定呈中性的是
A. 酸碱恰好完全反应的溶液 B. pH = 7的溶液
C. pH =14-pOH的溶液 D. pH = pOH的溶液
难度: 中等查看答案及解析
-
常温下,在纯水中加入下列物质,不会破坏水的电离平衡的是
A. 通入HCl气体 B. 加入NaOH固体 C. 加入NaCl固体 D. 加入金属钠
难度: 中等查看答案及解析
-
在2SO2(g)+O2(g)
2SO3(g) 的平衡体系中,当分离出SO3后下列说法中正确的是
A. 正反应速率增大 B. 平衡常数增大
C. 正反应速率大于逆反应速率 D. 逆反应速率一直减小
难度: 中等查看答案及解析
-
关于下图所示装置的叙述,正确的是( )
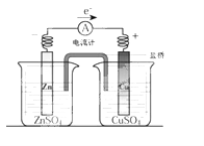
A.铜是阳极,铜片上有气泡产生
B.铜离子在铜片表面被还原
C.电流从锌片经导线流向铜片
D.正极附近的SO42-离子浓度逐渐增大
难度: 中等查看答案及解析
-
下列方程式正确的是
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B. 碳酸的电离方程式:H2CO3
2H++CO32-
C. 甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
中和热测定实验中,用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH进行实验,下列说法不正确的是
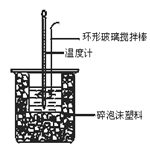
A. 改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,求出的中和热数值和原来相同
B. 测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
难度: 中等查看答案及解析
-
在任何温度下,下列反应都不能自发进行的是
A. 2O3(g) =3O2(g) ΔH<0 B. 2CO(g) =2C(s)+O2(g) ΔH>0
C. N2(g)+3H2(g) =2NH3(g) ΔH<0 D. CaCO3(s) =CaO(s)+CO2(g) ΔH>0
难度: 简单查看答案及解析
-
25℃时,下列说法不正确的是
A. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
B. 0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)
C. 将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
D. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-)
难度: 中等查看答案及解析
-
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中Ba2+恰好完全沉淀时,溶液pH=11,若反应后溶液体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1︰9 B. 1︰1 C. 1︰2 D. 1︰4
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 增大压强,活化分子百分数不变,化学反应速率增大
B. 升高温度,活化分子百分数增大,化学反应速率增大
C. 增大反应物浓度,活化分子百分数增大,化学反应速率增大
D. 使用催化剂,活化分子百分数增大,化学反应速率增大
难度: 困难查看答案及解析
-
下列措施或事实能用勒沙特列原理解释的是( )
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B.H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深
C.钢铁在潮湿的空气中更容易生锈
D.氯气可以用排饱和食盐水的方法收集
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是
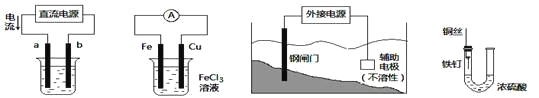
① ② ③ ④
A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C. 装置③中钢闸门应与外接电源的负极相连
D. 装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
下列溶液中离子一定能够大量共存的是
A. 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B. 由水电离的c(H+) =10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C. 在pH=1的溶液中:NH4+、K+、NO3-、Cl-
D. 有NO3—存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
难度: 简单查看答案及解析
-
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。下列说法不正确的是( )
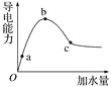
A. 在O点时,醋酸不导电
B. a、b、c三点,a点时醋酸溶液中H+浓度最小
C. b点时,醋酸电离程度最大
D. 可通过微热的方法使c点溶液中c(CH3COO-)增大
难度: 中等查看答案及解析
-
某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是
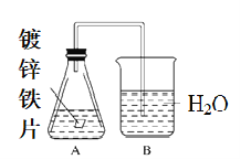
A. B中导气管里形成一段水柱
B. B中导气管中产生气泡
C. 金属片剪口处溶液变红
D. 锌被腐蚀
难度: 中等查看答案及解析
-
可逆反应2A(g)+B(g)
2C(g) ΔH <0,图像表达正确的为
A.
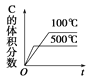 B.
B. 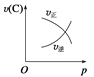 C.
C. 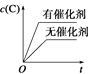 D.
D. 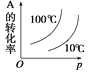
难度: 中等查看答案及解析
-
某锂离子二次电池装置如图所示,其放电时的总反应为:Lil-xCoO2+LixC6=6C+LiCoO2。下列说法正确的是
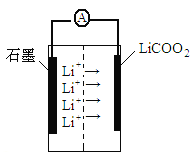
A.石墨为正极
B.充电时,阳极质量不变
C.充电时,阴极反应式为xLi-xe-=xLi+
D. 放电时,电池的正极反应为xLi++Lil-xCoO2+ xe-=LiCoO2
难度: 困难查看答案及解析
-
密闭容器中盛有1 mol PCl5,加热到200℃时发生了反应:PCl5(g)
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2 mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是( )
A. M>N B. M<N C. M=N D. 无法确定
难度: 中等查看答案及解析
-
下列关系的表述中,正确的是( )
A. 0.1 mol·L-1 NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
B. 中和pH和体积都相同的硝酸和醋酸溶液,消耗NaOH的物质的量之比为1∶1
C. 0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
难度: 中等查看答案及解析
-
研究不同条件对相同体积相同物质的量浓度的 H2O2分解速率的影响,得到如下数据。由此不能得出的结论是:
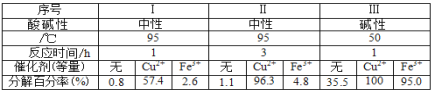
A. Cu2+与 Fe3+对 H2O2 分解都有催化作用,但 Cu2+催化效果更好
B. 由Ⅰ与Ⅱ可知其它条件相同时,时间越长, H2O2 分解越彻底
C. 由Ⅰ与Ⅲ可知其它条件相同时,温度越高, H2O2 分解越快
D. 由Ⅰ与Ⅲ可知其它条件相同时,碱性越强, H2O2 分解越快
难度: 中等查看答案及解析
-
模拟电渗析法将海水淡化的工作原理示意图如下。己知X、Y均为惰性电极,模拟海水中富含Na+、Cl—、Ca2+、Mg2+、SO42—等离子。下列叙述中不正确的是
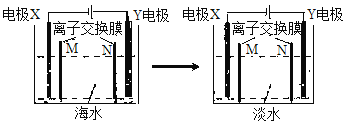
A.N是阴离子交换膜
B.Y电极上产生有色气体
C.X电极区域有浑浊产生
D.X电极反应式为4OH——4e—=O2↑+2H2O
难度: 中等查看答案及解析
-
钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
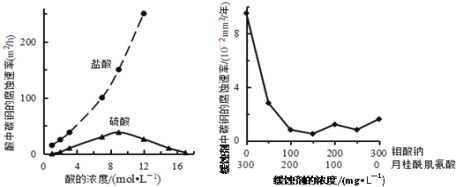
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
难度: 中等查看答案及解析
-
25 ℃时,在含CH3COOH和CH3COO-的溶液中,CH3COOH、CH3COO-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )
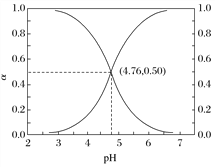
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变
难度: 困难查看答案及解析