-
下列实验不正确的是
序号
实验内容
实验目的
A
向5mL0.1mol/LK2Cr2O7溶液中滴加5滴浓硫酸
探究反应物浓度增大对化学平衡的影响
B
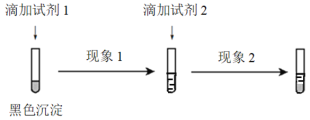
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶 液
说明一种沉淀能转化为另 一种溶解度更小的沉淀
C
室温下,用pH计测定浓度为0.1mol·L−1NaClO溶液和0.1mol·L−1CH3COONa溶液的pH
比较 HClO 和 CH3COOH 的 酸性强弱
D
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与社会生活技术密切相关,下列说法错误的是
A. 有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素,属于天然高分子化合物
B. 商代后期铸造出工艺精湛的后母戊鼎,该鼎属于铜合金制品
C. 静置后的淘米水能产生丁达尔效应,这种淘米水具有胶体的性质
D. 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料
难度: 中等查看答案及解析
-
由德国重离子研究中心人工合成的第 112 号元素的正式名称为“Copemicium”,相应的元素符号为“Cn”, 该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成 Cn 的过程可表示为:70Zn+208Pb===277Cn+1n。下列叙述中正确的是
A. 上述合成过程属于化学变化
B. 得到Cn元素的相对原子质量为277
C. Cn元素位于元素周期表的第七周期,是副族元素
D. 277112Cn的原子核内中子数比质子数多165
难度: 简单查看答案及解析
-
化学用语是学习化学的工具和基础,下列有关化学用语的表达正确的是
A. H2S 的电离方程式:H2S=2H++S2-
B. 氯化铵的电子式:
C. HClO的结构式为:H-O-Cl
D. 反应的电子转移情况:

难度: 简单查看答案及解析
-
工业上可用甲苯合成苯甲醛:
 ,
,下列说法正确的是
A. 甲苯分子中所有原子都在同一平面内 B. 反应①②③的反应类型相同
C. 一氯甲苯的同分异构体有3种 D. 苯甲醇可与金属钠反应
难度: 中等查看答案及解析
-
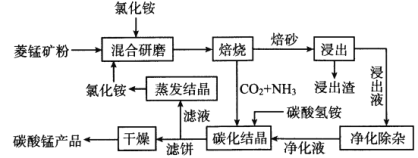
海水化学资源开发利用的部分过程如图所示,下列说法正确的是
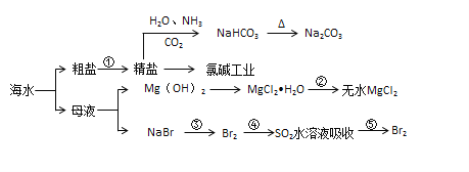
A. 从海水中得到粗盐主要是通过蒸发操作实现的
B. 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C. 在步骤②中可通过直接加热的方法实现
D. 在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大
难度: 简单查看答案及解析
-
为了探究铁铜及其化合物的性质,某同学设计并进行了下列实验。下列说法错误的是

A. 高温加热装置中发生的反应为3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)
B. 虚线框处宜选择的装置是甲
C. 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D. 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
难度: 中等查看答案及解析
-
2018年11月在法国凡尔赛召开的国际计量大会( General Conference on Weights and Measures,CGPM)第26次会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这常数被称为阿伏加德罗常数,单位为mol-1”。基于这一新定义,阿伏加德罗常数的不确定度被消除了。新定义将于2019年5月20日正式生效。NA为阿伏加德罗常数的值。下列说法错误的是
A. 22.4L(标准状况)氖气含有的电子数为10NA
B. 0.4 moI NH3与0.6mo1O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
C. 27g铝中加入足量1mol·L-1的NaOH溶液,转移的电子数为3NA
D. 常温常压下,水蒸气通过Na2O2使其增重2g时,反应中转移的电子数为NA
难度: 中等查看答案及解析
-
已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是

A. 若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+NO
B. 若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为△H 2=△H 1+△H 3
C. 若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)
4Na+O2↑
D. 若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质,实验室保存D溶液的方法是加入适量铁粉与适量盐酸
难度: 困难查看答案及解析
-
炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是
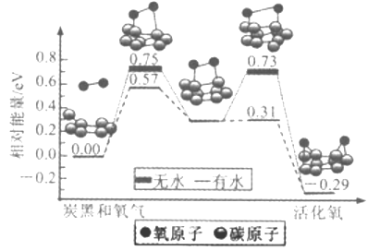
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
难度: 中等查看答案及解析
-
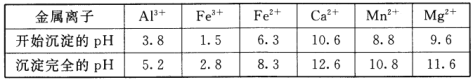
R、X、Y、Z是短周期元素,原子序数依次增大。R是自然界中组成物质种类最多的元素,R原子最外层电子数是X原子最外层电子数2倍。Z的最高价氧化物对应的水化物(M)是强电解质,向含Y元素的钠盐溶液中滴加M溶液,产生沉淀的物质的量与M的物质的量关系如图所示。下列推断正确的是
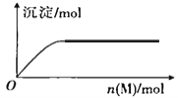
A. R的氢化物可能使溴水或酸性高锰酸钾溶液褪色
B. Y的气态氢化物热稳定性比R的强
C. 常温常压下,Z的单质一定呈黄绿色
D. X和Z组成的化合物属于共价化合物
难度: 中等查看答案及解析
-
向0.1mol·L-1的 NH4HCO3溶液中逐渐加入0.1mol·L-1NaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量与起始物质的量比值)。根据图像,下列说法不正确的是
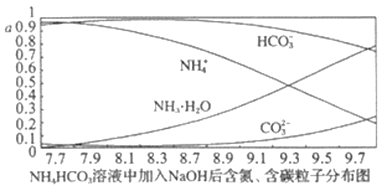
A. 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-=HCO3-+H2O
B. 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C. pH=9.5时,溶液中c(HCO3-)>c(NH3·H2O)>c(NH4+)>c(CO32-)
D. 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH===(NH4)2CO3+Na2CO3
难度: 困难查看答案及解析
-
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
CaSO4
CaCO3
MgCO3
Mg(OH)2
CuS
BaSO4
H2S
H2CO3
Ksp或Ka
9.1×10﹣6
2.8×10﹣9
6.8×10﹣6
1.8×10﹣11
6.3×10﹣36
1.1×10﹣10
K1=1.3×10﹣7
K2=7.1×10﹣15
K1=4.4×10﹣7
K2=4.7×10﹣11
则下列说法不正确的是
A. 相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4
B. 在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS﹣+Cu2+=CuS↓+H+
C. 除去锅炉中水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理
D. 在Mg(HCO3)2溶液中滴加足量澄清石灰水发生反应的离子方程式为:Mg2++2HCO3﹣+2Ca2++4OH﹣=Mg(OH)2↓+2CaCO3↓+2H2O
难度: 困难查看答案及解析
-
燃烧产生的尾气中含有一定量的NO。科学家们设计了一种间接电处理法除去其中NO的装置,如下图所示,它可以将NO转化为NH4+。下列说法正确的是
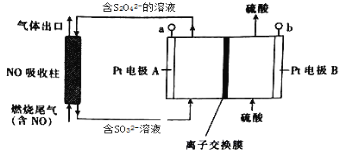
A. a连接电源的正极
B. Pt电极B上发生的电极反应为2H2O-4eˉ=O2↑+4H+
C. 当NO吸收柱中产生1mol SO32ˉ时,理论上处理的NO气体的体积为8.96L(标准状况)
D. 图中的离子交换膜应为阴离子交换膜
难度: 中等查看答案及解析
-
某化学反应2A(g)
B(g) + D(g)在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度随反应时间的变化情况如下表:
实验序号
0
10
20
30
40
50
60
(1)
800
1.0
0.80
0.67
0.57
0.50
0.50
0.50
(2)
800
c2
0.60
0.50
0.50
0.50
0.50
0.50
(3)
800
c3
0.92
0.75
0.63
0.60
0.60
0.60
(4)
820
1.0
0.40
0.25
0.20
0.20
0.20
0.20
根据上述数据,下列说法错误的是
A. 在(1)中,反应在10~20 min内A的平均速率为0.013 mol/(L·min)
B. 在(2)中,A的初始浓度c2<1.0 mol/L
C. 设(3)的反应速率为υ3,(1)的反应速率为υ1,则υ3 > υ1
D. 比较(1)和(4),可推测该反应的正反应是吸热反应
难度: 中等查看答案及解析