-
已知W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与Na的最高价氧化物对应的水化物混合,混合后溶液中离子浓度由大到小的顺序是___________________________________________________。
-
现有四种电解质溶液:
①NaHCO3 ②NaAlO2 ③CH3COONa ④NaOH
(1)若上述四种溶液pH相同,其物质的量浓度由大到小的顺序是___________________________________(填编号,下同)。
(2)将四种溶液稀释相同倍数时,其pH变化最大的是________。
(3)在上述四种溶液中,分别加入FeCl3溶液,能产生的共同现象是_____________________________________,能产生气体的是________。
-
已知H2CO3的Ka1=4.2×10-7 、K a2=5.6×10-11;HClO的Ka=3.0× 10-8, HF的Ka=3.5×10-4 。
a2=5.6×10-11;HClO的Ka=3.0× 10-8, HF的Ka=3.5×10-4 。
(1)NaClO溶液中通入少量CO2发生反应的离子方程式为______________________________________。
(2)在饱和氯水中加入NaHCO3,直至溶液的黄绿色褪去,则发生反应的离子方程式为___________________。
(3)常温下,将pH和体积都相同的氢氟酸和次氯酸分别加蒸馏水稀释,pH随溶液体积变化如图所示。
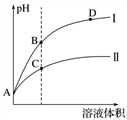
①曲线Ⅰ为________(填化学式,下同)稀释时pH的变化曲线。
 ②取
②取 A点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗________体积较小。
A点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗________体积较小。
(4)25 ℃时,将0.40 mol·L-1 HCN溶液与0.20 mol·L-1 NaOH溶液各100 mL混合后,测得溶液的pH=a(a>7)。则该溶液中所有离子浓度大小关系 为____________________________________;
为____________________________________;
c(HCN)-c(CN-)=__________________mol·L-1。(假设混合后体积等于两种溶液体积之和)
-
常温下有0.1 mol·L-1五种溶液NaOH、 NH3·H2O、 CH3COOH、HCl、NH4HSO4。
(1)已知CH3COOH溶液的pH=3,其电离度为________,由水电离的c(H+)=_________________________________________。
(2)NH3·H2O溶液和HCl溶液等体积混合后,溶液呈酸性的原因是(离子方程式表示)_________________________________________________________________________。
此时,该混合溶液中的微粒 浓度关系正确的是________(填字母)。
浓度关系正确的是________(填字母)。
A.c(Cl-)>c(H+) >c(NH )>c(OH-)
)>c(OH-)
B .c(Cl-)=c(NH
.c(Cl-)=c(NH )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
C.c(NH )+c(NH3·H2O)=0.1 mol·L-1
)+c(NH3·H2O)=0.1 mol·L-1
D.c(H+) =c(NH3·H2O)+c(OH-)
(3)已知NH3·H2O和NH4Cl等浓度混合时溶液呈碱性,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中各离子浓度的大小关系是________________________________。
-
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为______________________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)______________(填“>”“<”或“=”)c(CH3COO-)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________________________________。
(4) 25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-) =__________________。
-
常温下有四种溶液NaOH、 NH3·H2O、 HCl 、CH3COOH。
(1)相同pH的CH3COOH溶液和HCl溶液加水稀释,其 pH变化情况如图,其中表示HCl溶液的是曲线________,a、b两点中,导电能力更强的是________。
pH变化情况如图,其中表示HCl溶液的是曲线________,a、b两点中,导电能力更强的是________。

(2)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)>V(HCl),当溶液中c(NH3·H2O)=c(NH )时,溶液的pH=_______。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
)时,溶液的pH=_______。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
)=5∶9,此时溶液的pH=________。(25 ℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5)
 =________
=________(保留两位有效
数字)。

