-
三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是 ( )
A. 原子数目相等的三种气体,质量最大的是Z
B. 相同条件下,同质量的三种气体,气体密度最小的是X
C. 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D. 同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则其压强比为2∶1
难度: 中等查看答案及解析
-
下列有关操作的说法不正确的是
A. 《本草经集注》记载了鉴别硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,此处运用了物质升华的性质
B. 《本草纲目》记载了烧酒的制作工艺:“凡酸坏之酒,皆可蒸烧”,此处用到的操作是蒸馏
C. 《肘后备急方》一书中有“青蒿一握,以水二升渍,绞其汁”,此处用到的操作是溶解
D. 唐诗有“千淘万漉虽辛苦,吹尽黄沙始得金”的诗句,此处用到的操作是过滤
难度: 简单查看答案及解析
-
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是
A. 根据溶液导电能力强弱,将电解质分为强电解质和弱电解质
B. 根据分散系是否具有丁达尔效应,将分散系分为溶液、胶体和浊液
C. 根据纯净物中的元素组成,将纯净物分为单质和化合物
D. 根据反应中的能量变化,将化学反应分为氧化还原反应和非氧化还原反应
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 二氧化氯是一种高效安全的消毒剂
B. 沙子、石英、水晶等都是天然存在的二氧化硅
C. SO2能漂白石蕊试液、高锰酸钾溶液
D. 还原铁粉可以用作食品袋内的抗氧化剂
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. 硫原子结构示意图:
B. 次氯酸分子的结构式:H—O—C1
C. H2O2的电子式:
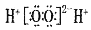
D. 碳酸氢钠的电离方程式:NaHCO3==Na++H++CO32-
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列叙述正确的是
A. 将NA个NH3分子溶于1L水中得到1mol·L-1的氨水
B. 15.6g由Na2O2和Na2S组成的混合物中含阴离子数为0.2NA
C. 一定条件下,0.1mol N2与0.3 mol H2充分反应,生成NH3分子数为0.2NA
D. 1mol Cl2参加反应,转移的电子数一定为2NA
难度: 中等查看答案及解析
-
下图表示的一些物质或概念间的从属关系中正确的是
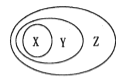
X
Y
A
A
二氧化氮
酸性氧化物
氧化物
B
硫酸
化合物
电解质
C
胶体
分散系
混合物
D
置换反应
氧化还原反应
离子反应
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列各组离子能大量共存的是
A. pH=2的溶液中:NH4+、Na+、Cu2+、Cl-
B. “84”消毒液的水溶液中:Fe2+、Ca2+、H+、Cl-
C. 加入KSCN显红色的溶液中:K+、NH4+、Cl-、S2-
D. 白醋中:K+、Na+、CO32-、SO42-
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数之和为46,它们在周期表中的相对位置如图所示。下列说法正确的是
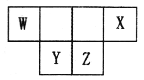
A. 原子半径大小顺序为:Y>Z>X
B. X元素最高价氧化物的水化物酸性最强
C. Y元素的简单氢化物稳定性最强
D. Z单质难溶于化合物WZ2
难度: 中等查看答案及解析
-
下列除杂方案错误的是
选项
被提纯物质
杂质
除杂试剂
除杂方法
A
CO(g)
CO2 (g)
氢氧化钠溶液、浓硫酸
洗气
B
Cl2(g)
HCl(g)
饱和食盐水、浓硫酸
洗气
C
NH4Cl(aq)
Fe3+
氢氧化钠溶液
过滤
D
Na2CO3(s)
NaHCO3(s)
灼烧
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列叙述正确的有
①碱性氧化物:Na2O2、MgO、A12O3
②常温下Cu、Fe、Al均不能和浓硫酸发生化学反应
③Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
④分别以熔融的NaCl、MgCl2、Al2O3为原料通过电解法制取金属Na、Mg、Al
⑤碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的均一、透明的分散系分别为:溶液、胶体
A. ①④⑤ B. ③④⑤ C. ②③④ D. ②④⑤
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2A13++3SO42-+3Ba2++6OH-=3BaSO4↓+2A1(OH)3↓
B. 将SO2气体通入NaC1O溶液中:SO2+2C1O-+H2O==SO42-+2HC1O
C. 向FeBr2溶液中通入过量C12:2Fe2++4Br-+2C12==2Fe3++2Br2+4C1-
D. VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O===Mn2++5VO2++2H+
难度: 困难查看答案及解析
-
下列有关实验装置或操作进行的相应实验,能达到实验目的的是
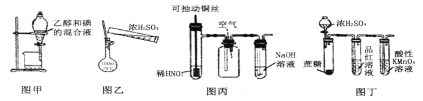
A. 用图甲所示装置分离乙醇和碘的混合液
B. 用图乙所示操作配制100mL 0.1mol·L-1硫酸溶液
C. 用图丙所示装置制备、收集纯净的一氧化氮
D. 用图丁所示装置检验浓硫酸与蔗糖反应产生的二氧化硫
难度: 中等查看答案及解析
-
海水综合利用的工艺流程如图所示(粗盐中的可溶性杂质有MgC12、CaC12、Na2SO4)。下列说法错误的是
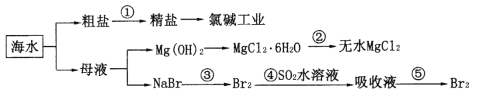
A. 步骤①加入试剂的顺序:水→NaOH溶液→Na2CO3溶液→BaC12溶液→过滤后加盐酸
B. 步骤②的操作是在氯化氢气流中加热MgC12·6H2O
C. 从步骤③到步骤⑤的目的是为了浓缩富集溴
D. 火力发电厂燃煤排放的含SO2的烟气经处理后可用在步骤④反应中
难度: 中等查看答案及解析
-
某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2===4LiCl+S+SO2。下列有关判断正确的是
A. 反应中被氧化的元素有Li和S B. SOCl2既是氧化剂又是还原剂
C. 还原产物包括LiCl和S D. 生成标况下1.12L SO2时,反应转移电子为0.2mol
难度: 简单查看答案及解析
-
己知A、B、C、D之间的置换转化关系如图所示、且A、D为单质。下列说法正确的是
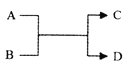
A. 若A为Fe,D为H2,则B一定为酸
B. 若A为非金属单质,则D 不一定为非金属单质
C. 若A为金属单质,D为非金属单质,则D一定是H2
D. 若A、D均为金属单质,则组成元素的金属性A必强于D
难度: 困难查看答案及解析
-
“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存利用。利用NaOH溶液来“捕捉”CO2的过程如图所示(部分条件及物质未标出)。
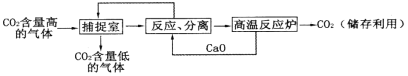
下列说法错误的是
A. 能耗大是该方法的一大缺点
B. 整个过程中,有2种物质可以循环利用
C. “反应、分离”环节中,有复分解反应发生
D. “反应、分离”环节中,分离的基本操作是蒸发、结晶
难度: 中等查看答案及解析
-
将32.5g Zn投入到V mL浓硫酸中共热,恰好完全反应,则可以确定的数据是
A. 所得溶液的浓度 B. 所得气体的质量
C. 所得气体在标准状况下的体积 D. 原硫酸的浓度
难度: 中等查看答案及解析

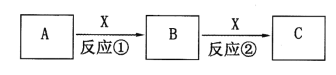
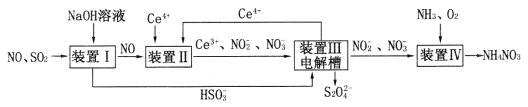
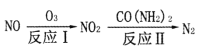 。反应I为NO+O3===NO2+O2,其还原产物是_________。反应Ⅱ中,氧化剂与还原剂的物质的量之比为__________。
。反应I为NO+O3===NO2+O2,其还原产物是_________。反应Ⅱ中,氧化剂与还原剂的物质的量之比为__________。