-
下面的“诗”情“化”意,分析正确的是
A. “粉身碎骨浑不怕,要留清白在人间”只发生了物理变化
B. “日照澄州江雾开”中伴有丁达尔效应
C. “试玉要烧三日满,辨材须待七年期”中“玉”的成分是硅盐酸,该句诗表明玉的硬度很大
D. “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒过程中,葡萄糖发生了水解反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,22.4LH2与254gI2充分反应,形成2NA个H-I键
B. 通入1molCl2的新制氯水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 64gCu与足量的硫粉加热,充分反应转移的电子数为NA
D. 等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和相等
难度: 中等查看答案及解析
-
根据下列实验操作和现象能推出相应结论的是
选项
实验操作和现象
结论
A
向NaAlO2溶液中滴加NaHCO3 溶液,产生白色沉淀
AlO2-与HCO3-发生了相互促进的水解反应
B
向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀
X不一定具有氧化性
C
灼热的木炭加入浓硝酸中,放出红棕色气体
一定是木炭与浓硝酸反应生成了NO2
D
将乙醇与浓硫酸共热,制得的气体直接通入酸性KMnO4溶液中,酸性KMnO4溶液褪色
说明制得的气体中含有乙烯
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是
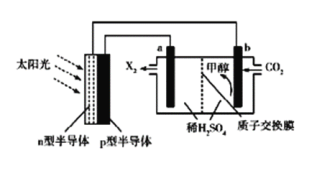
A. b极的电极反应式为CO2+6e-+6H+=CH3OH+H2O
B. n型半导体为负极
C. X2为O2,H+由b极向a极移动
D. 当制备32g甲醇时,质子交换膜两侧溶液相差104g
难度: 中等查看答案及解析
-
R、X、Y、Z是短周期元素,原子序数依次增大。R是自然界中组成物质种类最多的元素,R原子最外层电子数是X原子最外层电子数2倍。Z的最高价氧化物对应的水化物(M)是强电解质,向含Y元素的钠盐溶液中滴加M溶液,产生沉淀的物质的量与M的物质的量关系如图所示。下列推断正确的是
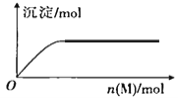
A. R的氢化物可能使溴水或酸性高锰酸钾溶液褪色
B. Y的气态氢化物热稳定性比R的强
C. 常温常压下,Z的单质一定呈黄绿色
D. X和Z组成的化合物属于共价化合物
难度: 中等查看答案及解析
-
某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是
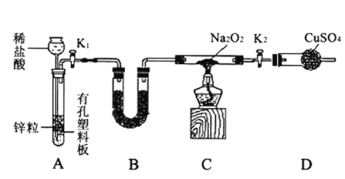
A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
难度: 中等查看答案及解析
-
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析不正确的是
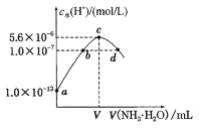
A. 硫酸的浓度为0.05mol/L
B. V=20
C. c点所示的溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. d点所示溶液中:c(NH4+)=c(SO42-)
难度: 中等查看答案及解析