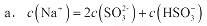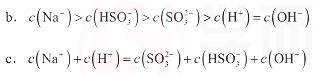-
直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
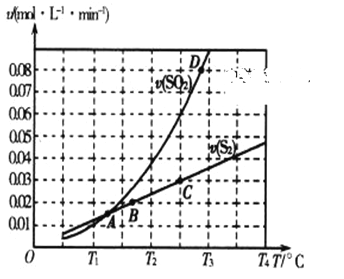
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
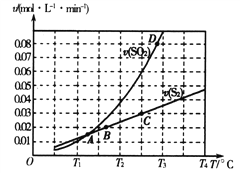
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时2.0mol·L-1的氨水中,NH3·H2O的电离度α=______(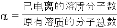 ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的 =_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
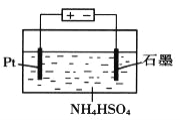
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8
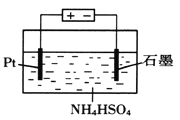
①写出电解NH4HSO4溶液的化学方程式____________。
②若用9.65A的恒定电流电解饱和NH4HSO4溶液1小时,理论上生成的(NH4)2S2O8的物质的量为________。(F=96500C·mol-1)
-
直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。
(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)  S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时,将含SO2的烟气通入一定浓度的氨水中,当溶液显中性时,溶液中的 =_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
=_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
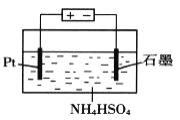
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8,请写出电解NH4HSO4溶液的化学方程式_______________。
-
直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。
(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)  S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
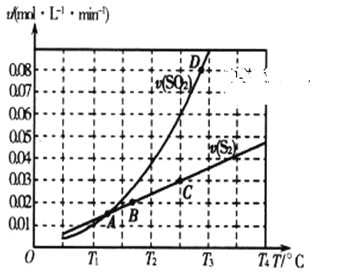
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时,将含SO2的烟气通入一定浓度的氨水中,当溶液显中性时,溶液中的 =_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
=_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8,请写出电解NH4HSO4溶液的化学方程式_______________。
-
直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
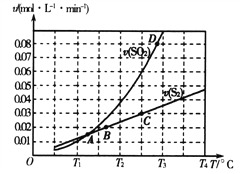
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时2.0mol·L-1的氨水中,NH3·H2O的电离度α=______(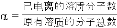 ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的 =_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8
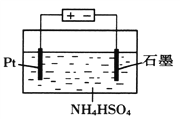
①写出电解NH4HSO4溶液的化学方程式____________。
②若用9.65A的恒定电流电解饱和NH4HSO4溶液1小时,理论上生成的(NH4)2S2O8的物质的量为________。(F=96500C·mol-1)
-
直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)如图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)  S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
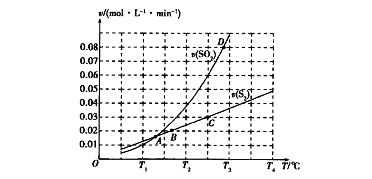
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
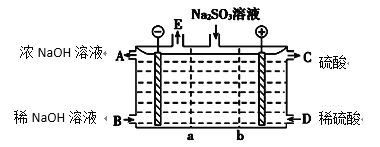
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
①a表示________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中A为浓氢氧化钠溶液,C为硫酸溶液,E表示________(写化学式)。
②电解过程中,阳极的电极反应式为_______________________________________。
-
SO2是一种重要的化工原料,也是一种环境污染物。
(1)SO2可用于工业制Br2过程中吸收潮湿空气中的Br2,反应的离子方程式是________ 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的反应:。
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol•L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
①此时溶液中c(SO32-)的浓度是0.2 mol•L-1,则溶液中c(HSO3-)是_________mol•L-1,由此说明NaHSO3溶液显________性,用化学平衡原理解释:________。
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是________。
-
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
| n(SO32﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如图:
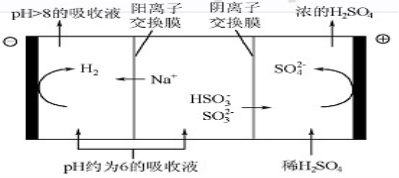
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
-
(10分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________。
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣),n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):,n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
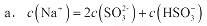
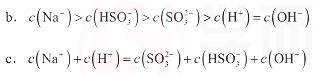
(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
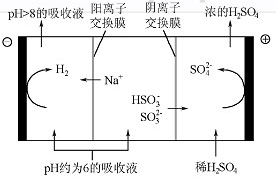
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
-
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是______.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:______.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
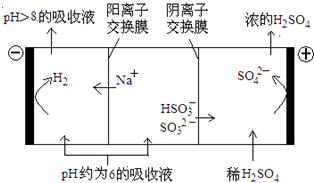
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是______.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:______.
-
直接排放含SO2,的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2在钠碱循环法中,用Na2SO3溶液作为吸收液,吸收液吸收SO2的过程中,pH随n(SO32-): n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(1)上表判断NaHSO3溶液显___________性,用化学平衡原理解释____________________________________________________________________________
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a. c(Na+ )=" 2c(" SO32-) + c( HSO3-)
b. c(Na+ )> c( HSO3-)>c( SO32-) >c(H+)>c(OH-)
c. c(Na+ )+ c(H+)="c(" HSO3-)+c( SO32-) +c(OH-)
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
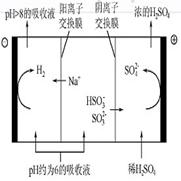
(3)HSO3-在阳极放电的电极反应式是_________________________________________
(4)当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
________________________________________________________________________

S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:




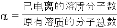 ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的








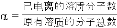 ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的