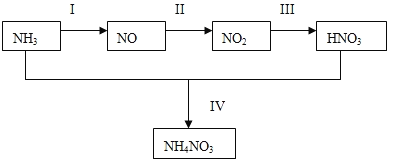
-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项
现象或事实
解释
A
用热的烧碱溶液洗去油污
Na2CO3可直接和油污反应
B
漂白粉在空气中久置变质
漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3
C
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl反应生成氨气会降低肥效
D
FeCl3溶液可用于铜质印刷线路板制作
FeCl3能从含有Cu2+的溶液中置换出铜
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 氢氧化铝、碳酸钠都是常见的胃酸中和剂
B. 长期摄入肉、蛋、鱼偏多易导致血液偏酸性
C. 碘酒中的碘因有还原性而起到杀菌消毒作用
D. 碘盐、铁强化酱油等营养强化剂适合所有人食用
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 仅用酸性高锰酸钾溶液可区分苯和甲苯
B. 仅用氯化铁溶液可区分苯酚稀溶液和甘油
C. 仅用硝酸和硝酸银溶液可验证卤代烃中卤原子的种类
D. 仅用溴的四氯化碳溶液可区别液态的植物油和动物油
难度: 中等查看答案及解析
-
下列关于下图所示电化学装置的分析正确的是
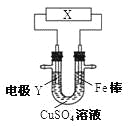
A. 若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜
B. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护
C. 若X为电流计,Y为锌棒,则SO42-移向Fe棒
D. 若X为导线,Y为铜棒,则Fe棒发生还原反应
难度: 中等查看答案及解析
-
若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
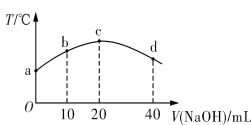
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
难度: 困难查看答案及解析
-
下列化合物的俗称与化学式不对应的是
A. 绿矾-FeSO4·7H2O B. 芒硝-Na2SO4·10H2O
C. 明矾- Al2(SO4)3·12H2O D. 胆矾- CuSO4·5H2O
难度: 中等查看答案及解析
-
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2 + 02=Cu2S+2FeS+S02下列说法正确的是
A. S02既是氧化产物又是还原产物 B. CuFeS2仅作还原剂,硫元素被氧化
C. 每生成1mol Cu2S,有4 mol硫被氧化 D. 每转移1.2 mol电子,有0.3 mol硫被氧化
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式为
A. 硫化亚铁溶于稀硝酸中:FeS+2H+ =Fe2+ + H2S↑
B. NH4HC03 溶于过量的 NaOH 溶液中:HC03- +OH- =CO32- +H20
C. 少量 C02 通入苯酚钠溶液中:2C6H5O-+C02 + H20=2C6H50H+C032-
D. 大理石溶于醋酸中: CaC03 + 2CH5COOH = Ca2+ + 2CH3COO- + C02↑+ H20
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA
B. 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C. 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
D. 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
难度: 简单查看答案及解析
-
有关NaHC03与Na2C03的性质,下列叙述中不正确的是
A. Na2C03和NaHC03粉末与同浓度盐酸反应时,Na2C03因碱性强,所以与盐酸反应放出气体速度快
B. 等物质的量的两种盐与同浓度盐酸反应,Na2C03所消耗盐酸的体积是 NaHC03的两倍
C. 向Na2C03饱和溶液中通人过量CO2,有NaHC03结晶析出
D. Na2C03和NaHC03溶液分别和BaCl2溶液反应,现象不同
难度: 中等查看答案及解析
-
为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》。下列做法有利于该目标实现的是
A. 推广使用含磷洗涤剂 B. 用O3替代Cl2作饮用水消毒剂
C. 用工业污水直接灌溉农田 D. 含H2SO4的废水用BaCl2处理后排放
难度: 简单查看答案及解析
-
某含碳、氢、氧三种元素的有机物的蒸气密度是CO2的2倍(相同条件),该有机物中氧原子以“
”结构存在的同分异构体的数目有( )
A. 2种 B. 4种 C. 6种 D. 8种
难度: 中等查看答案及解析
-
下列说法正确的是
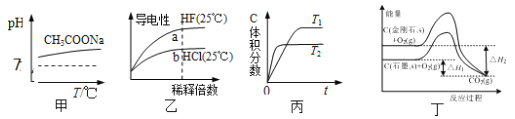
A. 由图甲可知,升高温度醋酸钠的水解程度增大
B. 由图乙可知,a点Kw的数值比b点Kw的数值大
C. 由图丙可知,反应A(g)+B(g)
2C(g)是吸热反应
D. 由图丁可知,反应C(金刚石,s)= C(石墨,s)的焓变△H=△H1—△H2
难度: 简单查看答案及解析
-
设NA是阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA
B. 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA
D. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
难度: 中等查看答案及解析
-
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。

下列说法错误的是( )
A. 步骤(1)需要过滤装置 B. 步骤(2)需要用到分流漏斗
C. 步骤(3)需要用到坩埚 D. 步骤(4)需要蒸馏装置
难度: 简单查看答案及解析
-
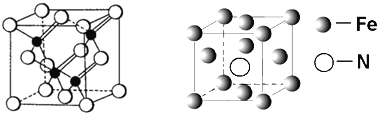
X、Y、Z、W、U是分别位于短周期的元素,原子序数依次递增。X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13。Y元素的单质在X的某种氧化物中可燃。下列说法正确的是
A. W的最高价氧化物能与水反应生成相应的酸
B. Y、Z元素的单质作电极,在NaOH溶液环境下构成原电池,Z电极上产生大量气泡
C. 室温下,0.05 mol/L U的气态氢化物的水溶液的pH > 1
D. Y 、Z 、U元素的简单离子半径由大到小的顺序:Y > Z > U
难度: 困难查看答案及解析
-
常温下,用0.10 mol·L—1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L—1 CH3COOH溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是
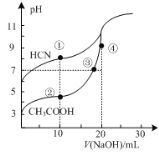
A. 点①和点②所示溶液中:c(CH3COO—)< c(CN—)
B. 点③和点④所示溶液中:c(Na+)>c(OH—) >c(CH3COO—) >c(H+)
C. 点①和点②所示溶液中:c(CH3COO—)-c(CN—) = c(HCN)- c(CH3COOH)
D. 点②和点③所示溶液中都有: c(CH3COO—)+c(OH—)= c(CH3COOH) +c(H+)
难度: 中等查看答案及解析