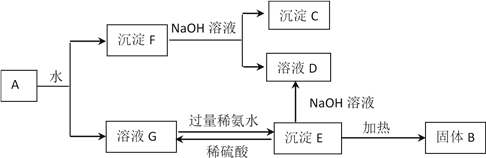
-
当钠、钾等金属不慎着火时,可以用来灭火的是:( )
A. 水 B. 煤油 C. 沙子 D. 泡沫灭火剂
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B. 常温常压下,11.2L甲烷中含有的氢原子数为2NA
C. 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
难度: 中等查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是
A. CH3COOH B. Cl2 C. NH4HCO3 D. SO2
难度: 中等查看答案及解析
-
下列A~D四组反应中.其中I和Ⅱ可用同一个离子方程式表示的是
I
II
A
把金属铁放入稀硫酸中
把金属铁放入稀硝酸中
B
Ca(HCO3)2溶液中加入足量的NaOH溶液
Ca(OH)2溶液中加入足量的NaHCO3溶液
C
将0.1 molCl2通入含0.3 mol FeBr2的溶液
将0.3 mol Cl2通入含0.1 mol FeBr2的溶液
D
将少量Na2CO3溶液滴入到足量HCl溶液
将少量HCl溶液滴入到足量Na2CO3溶液
难度: 困难查看答案及解析
-
实验室常用NaNO2与NH4Cl反应制取N2。下列有关说法正确的是
A. NaNO2是还原剂 B. NH4Cl中N元素被还原
C. 生成1molN2时转移6mol电子 D. 氧化剂和还原剂的物质的量之比是1:1
难度: 中等查看答案及解析
-
除去Na2CO3固体中少量NaHCO3的最佳方法是
A. 加入适量盐酸 B. 加入NaOH溶液 C. 加热 D. 配成溶液后通入CO2
难度: 中等查看答案及解析
-
以下各组溶液中Cl-的物质的量浓度与300 mL 1 mol/L NaCl溶液中Cl-的物质的量浓度相同的是
A. 100 mL 1 mol/L AlCl3溶液 B. 200 mL 1 mol/L MgCl2溶液
C. 100 mL 0.5 mol/L CaCl2溶液 D. 100 mL 2 mol/L KCl溶液
难度: 简单查看答案及解析
-
下列反应中,铁元素被氧化的是
A. FeS+2HCl=FeCl2+H2S↑ B. Fe+H2S04=FeS04+H2↑
C. FeO+2HCl=FeCl2+H20 D. Fe203+3CO
2Fe+3C02
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 1.0mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B. 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C. pH=12的溶液:K+、Na+、CH3COO-、Br-
D. 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
下列反应中,可用离子方程式H++OH-===H2O表示的是
A. NH4Cl+NaOH
NaCl+NH3↑+H2O
B. Mg(OH)2+2HCl===MgCl2+2H2O
C. NaOH+NaHCO3===Na2CO3+H2O
D. NaOH+HNO3===NaNO3+H2O
难度: 中等查看答案及解析
-
将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A. KSCN B. BaCl2 C. HCl D. NaOH
难度: 中等查看答案及解析
-
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是 ( )
①NaHCO3②Al2O3③Al (OH )3④Al.
A. ③④ B. ②③④ C. ①③④ D. 全部
难度: 中等查看答案及解析
-
下列氧化还原反应中,水作为氧化剂的是
A. CO+H2O
CO2+H2 B. 3NO2+H2O=2HNO3+NO
C. 2Na2O2+2H2O=4NaOH+O2↑ D. 2F2+2H2O=4HF+O2
难度: 中等查看答案及解析
-
在80 g密度为d g/cm3的硫酸铁溶液中,含有2.8 g Fe3+离子,则此溶液中SO42-的物质的量浓度为(单位为mol·L-1)
A.
B.
C.
D.
难度: 中等查看答案及解析
-
某溶液离子及浓度如下表
离子
SO42-
NO3-
H+
Na+
Mn+
浓度(mol·L-1)
1
3
2
1
a
则Mn+、a可能为
A. NH4+、2 B. Ba2+、1 C. Al3+、2 D. Fe2+、1
难度: 简单查看答案及解析
-
用1 L 1.0 mol/L NaOH溶液吸收0.8 mol CO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比约为( )
A. 1∶3 B. 1∶2
C. 2∶3 D. 3∶2
难度: 简单查看答案及解析
-
在溶液中0.2 mol X2O72-恰好能使0.6 mol SO32-被完全氧化,则X2O72-被还原后X元素的化合价为
A. +1 B. +2 C. +3 D. +4
难度: 简单查看答案及解析
-
取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为
A. 1:1 B. 2:3 C. 3:2 D. 1:6
难度: 简单查看答案及解析
-
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)
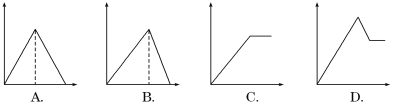
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A. ①③ B. ②④ C. ①②④ D. ②③④
难度: 简单查看答案及解析