-
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A. 萃取 B. 渗析 C. 蒸馏 D. 干馏
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多
D. 催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率
难度: 中等查看答案及解析
-
以下关于甲烷的说法中错误的是
A. 甲烷分子是由极性键构成的分子
B. 甲烷分子具有正四面体结构
C. 甲烷分子中四个C-H键是完全等价的键
D. 甲烷分子中具有非极性键
难度: 简单查看答案及解析
-
类推是学习和研究的重要思维方法。下列类推结论正确的是
化学事实
类推结论
A
Al在O2中燃烧生成Al2O3
Fe在O2中燃烧也生成Fe2O3
B
pH=3的盐酸稀释1000倍后pH=6
pH=6的盐酸稀释1000倍后pH=9
C
用电解熔融MgCl2的方法冶炼金属镁
用电解熔融NaCl的方法制取金属钠
D
将CO2和Na2O2反应生成Na2CO3与O2
将SO2与Na2O2反应生成Na2SO3与O2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值.下列叙述正确的是
A. 在1.0mol·L-1 的NaHCO3溶液中,含有的Na+ 数为1NA
B. 标准状况下,2.24 LCCl4中含有的分子总数为0.1NA
C. 金属钠与水反应,生成22.4L氢气时,转移的电子数为2NA
D. 1 mol氢氧根离子与1 mol铵根离子所含电子数均为10 NA
难度: 中等查看答案及解析
-
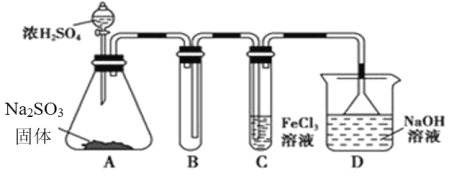
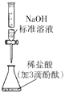
下列有关实验装置进行的相应实验,能达到实验目的的是
图(1)
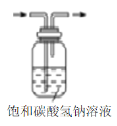 图(2)
图(2)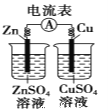
图(3)
 图(4)
图(4)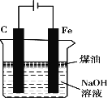
A. 图(1)用于除去CO2中的HCl气体
B. 图(2)表示已组装的铜锌原电池
C. 图(3)用于测定某稀盐酸的物质的量浓度
D. 用图(4)装置制备Fe(OH)2并能较长时间观察其颜色
难度: 中等查看答案及解析
-
可逆反应:2NO2(g)⇌2NO(g)+O2(g),在2L的密闭容器中反应,达到平衡的标志是
A. 单位时间内生成n mol O2的同时生成2n mol NO
B. 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
C. 混合气体的颜色不再改变的状态
D. 混合气体的密度不再改变的状态
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O
2Cu+O2↑+4H+
D. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
难度: 困难查看答案及解析
-
下列说法正确的是
A. 无论是纯水,还是酸性、碱性或中性稀溶液,其c(H+)·c(OH-)=1×10-14
B. c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液
C. 常温下,Ksp[Mg(OH)2]=5.6×10−12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10−4 mol·L−1
D. 加热蒸干AlCl3溶液然后灼烧得到Al(OH)3固体
难度: 困难查看答案及解析
-
依据如图判断,下列说法正确的是( )
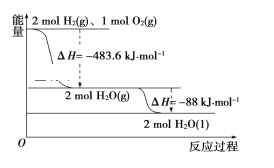
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,且Y、Z、W在周期表的位置关系如下图所示。已知X与W能形成最简单的有机物,则下列有关说法正确的是
A. X能分别与Y、W形成化合物,且其所含化学键类型完全相同
B. W有多种同素异形体,且均具有高熔点、高沸点的性质
C. X的离子半径一定小于与Y同族的短周期元素的离子半径
D. Y、Z与X的常见稳定液态氧化物反应的剧烈程度Y大于Z
难度: 中等查看答案及解析
-
常温下,将一定浓度的某一元酸HA和0.1 mol·L-1 NaOH溶液等体积混合后,下列说法正确的是
A. 若pH=7,HA的浓度一定为0.1 mol·L-1
B. 若pH=7,A-的浓度大于Na+的浓度
C. 若pH<7,溶液中的微粒浓度关系为: c(Na+)=c(HA)+c(A-)
D. 若pH=12,且HA为强酸时,HA的浓度应为0.08 mol·L-1
难度: 中等查看答案及解析
-
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
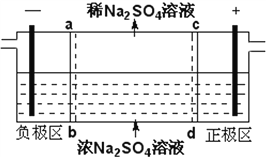
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 中等查看答案及解析
-
25℃时,下列有关溶液中各微粒的物质的量浓度关系正确的是
A.0.1mol/L的NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.0.1mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
C.pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-)
D.pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)
难度: 中等查看答案及解析