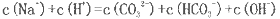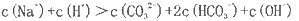-
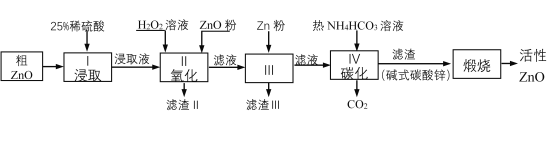
活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
已知各相关氢氧化物沉淀pH范围如下表所示:
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要______(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是____________(用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________。
(4)步骤III中加入Zn粉的作用是:①__________________;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为____________。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
①取1.000g活性氧化锌,用15.00mL 1.000mol·L-1硫酸溶液完全溶解,滴入几滴甲基橙。②用浓度为0.5000mol·L-1的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的依据是_________;所得活性氧化锌的纯度为_________。
-
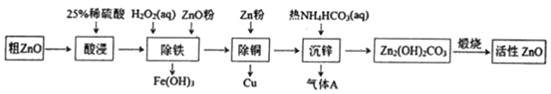
活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图:
已知相关氢氧化物沉淀pH范围如表所示
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O
-
活性氧化锌是一种多功能性的新型材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
已知各相关氢氧化物沉淀pH范围如下表所示:
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
步骤II中,在酸性溶液中加入KMnO4的作用是将Fe2+ 氧化成Fe3+,离子方程式为 ;
(2)用ZnO调节pH,以除去含铁杂质。检验沉淀是否完全的实验操作是 ;调节pH的适宜范围是 。
(3)步骤III中加入Zn粉的作用是① ,②进一步调节溶液PH值。
(4)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
取1.000g活性氧化锌,用15.00mL 1.00mol/L硫酸溶液完全溶解,滴入几滴指示剂,再用0.50mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL,通过计算可以得到活性氧化锌的纯度,由表中Zn(OH)2PH变化可知,滴入的最理想的指示剂是 (填“酚酞”、“甲基橙”或“石蕊试剂”)。
-
纳米氧化锌是一种多功能性的新型无机材料,在橡胶、玻璃、涂料等各个领域广泛的应用。工业由粗氧化锌(含少量FeO、CuO 等杂质) 制备活性氧化锌的工业流程如下:
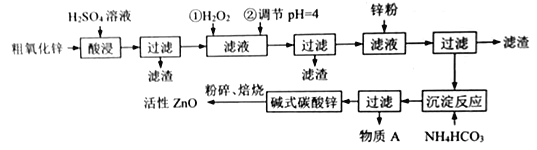
已知:Fe3+、Fe2+、Cu2+完全沉淀的pH分别是:3.2,8.1,6.7
(1)“酸浸”时用的硫酸溶液的密度为1.4g/mL,质量分数为70%,则该硫酸的物质的量浓度为____。
(2)焙烧前粉碎的目的是____________________________________________。
(3)滤液中加锌粉的目的是_____________________________________。
(4)物质A的主要成分_______________(填化学式),检验A中阳离子的方法是_______________。
(5)滤液中加H2O2发生反应的离子方程式__________________________。
(6)6.82g碱式碳酸锌[aZn(OH)2·bZnCO3·cH2O]恰好溶解在40mL3mol/LHCl中,同时产生448mLCO2(标准状况下),试推算碱式碳酸锌的化学式为___________________________。
-
活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1-100纳米。某化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:

(1)通过__________(填操作名称)可以检验流程中滤液2中含有Na+。
(2)若上述流程图中Na2CO3溶液的pH=12,下列说法正确的是___________。
A该溶液中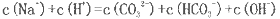
B.该溶液中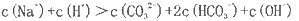
C.该溶液中
D.若将该溶液稀释至100倍,则pH=10。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。取0.5L该溶液先加入___________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0 009 mol/L,则该溶液中至少应加入_______molKMnO4 .
-
(15分)聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:

写出铝、氧化铝分别与盐酸反应的离子方程式:
, ,
-
高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
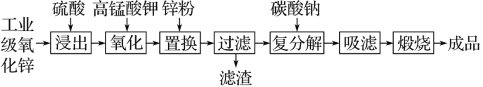
已知Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写两种):___________;___________。
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:MnO +Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
+Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
(3)加入锌粉的目的是_______________________________________________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04 mg·L-1、c(Mn2+)=1.65 mg·L-1,加入KMnO4溶液反应一段时间后,溶液中c(Fe3+)=0.56 mg·L-1,若溶液pH=3,则此时Fe3+__________(填“能”或“不能”)生成沉淀。
(5) 已知:常温下,①Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。
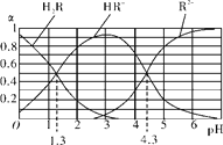
①比较H2R ,HR-,H2CO3三者的酸性强弱_________________________________
②NaHR溶液中存在 = _______________________
= _______________________
-
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝.实验步骤如图:

(1)写出铝、氧化铝分别与盐酸反应的离子方程式:______,______,
(2)用36.5%的盐酸配制20%的盐酸,操作步骤是______(依次写出),配制过程中所需的定量仪器是______.
(3)聚合铝(PAC)的分子式为[Al2(OH)aClb]m,聚合铝中OH-与Al3+的比值对净水效果有很大影响,定义盐基度B=n(OH-)/3n(Al3+),当B=2/3时,b=______(填入合适数字).
(4)聚合过程主要利用了Al3+的性质是______.
(5)要测定1mol聚合铝中a的值.
①测定时所需的试剂是______(填代号).
(a) NaOH(b)AgNO3(c) pH试纸(d) HNO3
②需要直接测定的物理量是______(用文字表示).若该物理量的数值用β表示,试写出聚合铝中a值的表达式______.
③测定过程中所需的基本操作是______(按操作先后顺序的代号列出,可重复选择).
(a) 洗涤(b) 过滤(c) 称量 (d) 干燥(e) 冷却.
-
(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
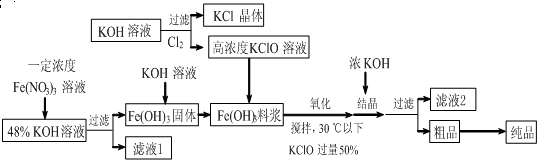
(1)上述氧化过程中,发生反应的离子方程式是:,控制反应温度30℃以下的原因是:。
(2)结晶过程中加入浓KOH溶液的作用是:。
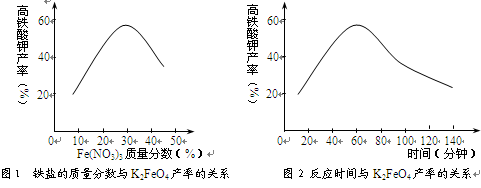
(3)根据图1、图2回答:为了获取更多的高铁酸钾,铁盐的质量分数应控制在________附近、反应时间应控制在________。
-
碳酸镁晶须是一种新型吸波隐形材料中的增强剂。某工厂以MgCl2(含少量杂质FeCl2、FeCl3)为原料制备碳酸镁晶须(MgCO3·H2O)的工艺流程如下:
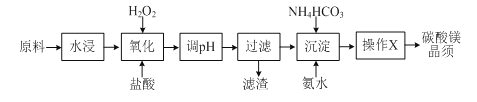
已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.9 | 11.0 |
(1)写出“氧化”过程中发生的离子反应方程式_______________。
(2)pH调节的范围___________,滤渣的主要成分___________(填化学式)。
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法______________。
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl-的浓度为0.455 mol·L-1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl-的浓度为0.460 mol·L-1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L-1 NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程)。 _______________________