-
高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
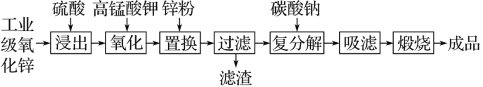
已知Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写两种):___________;___________。
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:MnO +Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
+Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
(3)加入锌粉的目的是_______________________________________________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04 mg·L-1、c(Mn2+)=1.65 mg·L-1,加入KMnO4溶液反应一段时间后,溶液中c(Fe3+)=0.56 mg·L-1,若溶液pH=3,则此时Fe3+__________(填“能”或“不能”)生成沉淀。
(5) 已知:常温下,①Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。
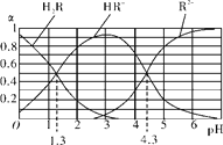
①比较H2R ,HR-,H2CO3三者的酸性强弱_________________________________
②NaHR溶液中存在 = _______________________
= _______________________
-
氧化锌为白色粉末,可用于皮肤病的治疗。提纯工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
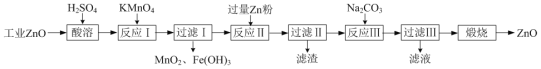
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 8.2 | 8.9 |
(1)写出两种“酸溶”时可以加快反应速率的方法__________、__________。
(2)“反应Ⅰ”溶液的pH≈5,“反应Ⅰ”目的是除去Fe(Ⅱ)、Mn(Ⅱ),写出“反应Ⅰ”中除去Mn(Ⅱ)的离子方程式:__________。
(3)“过滤Ⅱ”所得滤渣的成分为__________。
(4)向“过滤Ⅱ”所得滤液中滴加Na2CO3溶液,所得沉淀为ZnCO3,若反过来滴加,则沉淀中会含有Zn(OH)2。反过来滴加生成Zn(OH)2的原因是__________。
⑸“过滤Ⅲ”所得沉淀需进行洗涤,检查沉淀已经洗涤干净的方法是__________。
-
氧化锌为白色粉末,可用于皮肤病的治疗。提纯工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
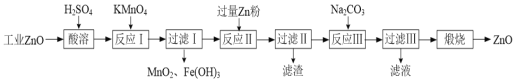
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 8.2 | 8.9 |
(1)写出两种“酸溶”时可以加快反应速率的方法______________、_____________。
(2)“反应Ⅰ”溶液的pH≈5,“反应Ⅰ”目的是除去Fe(Ⅱ)、Mn(Ⅱ),写出“反应Ⅰ”中除去Mn(Ⅱ)的离子方程式:_________________________________________。
(3)“过滤Ⅱ”所得滤渣的成分为___________。
(4)“过滤Ⅲ”所得沉淀需进行洗涤,检查沉淀已经洗涤干净的方法是_______________。
-
纳米氧化锌是一种多功能性的新型无机材料,在橡胶、玻璃、涂料等各个领域广泛的应用。工业由粗氧化锌(含少量FeO、CuO 等杂质) 制备活性氧化锌的工业流程如下:
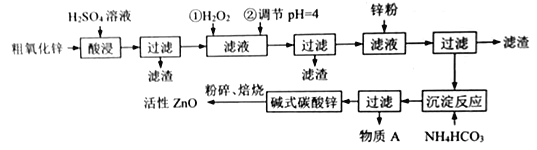
已知:Fe3+、Fe2+、Cu2+完全沉淀的pH分别是:3.2,8.1,6.7
(1)“酸浸”时用的硫酸溶液的密度为1.4g/mL,质量分数为70%,则该硫酸的物质的量浓度为____。
(2)焙烧前粉碎的目的是____________________________________________。
(3)滤液中加锌粉的目的是_____________________________________。
(4)物质A的主要成分_______________(填化学式),检验A中阳离子的方法是_______________。
(5)滤液中加H2O2发生反应的离子方程式__________________________。
(6)6.82g碱式碳酸锌[aZn(OH)2·bZnCO3·cH2O]恰好溶解在40mL3mol/LHCl中,同时产生448mLCO2(标准状况下),试推算碱式碳酸锌的化学式为___________________________。
-
金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+ ),下列叙述正确的是( )
A. 阳极发生还原反应,其电极反应:Ni2++2e-= Ni
B. 电解后,电解槽底部的阳极泥中只有Cu和Pt
C. 电解后,溶液中存在的阳离子只有Fe2+和Zn2+
D. 电解过程中,阳极质量的减少与阴极质量的增加相等
-
金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是
A.阳极发生还原反应,其电极反应:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
-
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e-==Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
-
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
-
金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A. 阳极发生还原反应,其电极反应式为:Ni2++2e- = Ni
B. 电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C. 电解后,电解槽底部的阳极泥中含有Cu和Pt
D. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
-
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是
(已知:氧化性Fe2+<Ni2+<Cu2+)
A. 阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt

+Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________

= _______________________


