-
除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)  CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
① 此反应的化学平衡常数表达式为________;
② 下列能增大碳的转化率的措施是________ 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g) +3/2O2(g)  CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是_______(填“X”或“Y”或“Z”),选择的理由是_______。
(3)合成气合成甲醇的主要反应是:2H2(g)+CO(g)  CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
① 该时间段内反应速率v(H2)=______ mol·L-1·min-1。
② 此时,正、逆反应速率的大小:v正______v逆(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是____________。
(5)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2 + 4KOH=2K2CO3+6H2O该电池负极的电极反应式为______。
-
甲酸钠广泛用作催化剂和稳定合成剂,印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。用电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)其合成部分工艺流程如下:
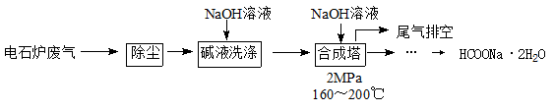
(1)上述工艺用碱液洗涤的目的是 ,可能发生的反应有 (列举两例)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是 ;最后排空的尾气主要成分是 。
(3) 合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa·2H2O的主要步骤有 、 、 ,再经洗涤干燥得到。
(4) 甲酸钠高温时分解制取草酸钠的化学方程式为 。
(5) 在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要工业产品保险粉(Na2S2O4)同时产生二氧化碳,该反应离子方程式为 。
-
合成氨所需的氢气由煤和水反应制得,其中有一步反应为CO+ H2O(气)  CO2+H2,△H<0。欲提高CO转化率可采用的方法是 ①降低温度 ②增大压强 ③使用催化剂 ④增大CO的浓度 ⑤增大水蒸气的浓度
CO2+H2,△H<0。欲提高CO转化率可采用的方法是 ①降低温度 ②增大压强 ③使用催化剂 ④增大CO的浓度 ⑤增大水蒸气的浓度
A.①②③ B.④⑤ C.①⑤ D.⑤
-
发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)⇌CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H______(填“增大”、“减小”或“不变”),判断的理由是________。
(2)CO2制备甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

① 该反应化学平衡常数K的表达式是____________________。
②0~9min时间内,该反应的平均反应速率ν(H2) =_______。
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a. 0< Q <29.5 b. 29.5< Q <36.75 c. 36.75< Q <49 d. 49< Q <98
④在一定条件下,体系中CO2的平衡转化率(α)与L和 X的关系如图所示,L和X分别表示温度或压强。
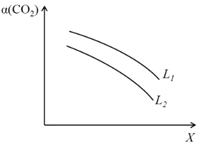
i. X表示的物理量是:_____________。
ii. 判断L1与L2的大小关系,并简述理由:_______________________。
-
实验室中,下列除去括号内杂质的有关操作正确的是
A.苯(硝基苯):加少量水振荡,待分层后分液
B.乙醇(水):加新制生石灰,蒸馏
C.CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D.乙烷(乙烯):催化加氢
-
实验室中,下列除去括号内杂质的有关操作正确的是
A.苯(硝基苯):加少量水振荡,待分层后分液
B.乙醇(水):加新制生石灰,蒸馏
C.CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D.乙烷(乙烯):催化加氢
-
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) △H > 0,欲提高反应的速率和C(s)的转化率,可采用的措施为
CO(g)+H2(g) △H > 0,欲提高反应的速率和C(s)的转化率,可采用的措施为
A.降温 B.增大水蒸气的浓度 C.增大C(s)的量 D.增大压强
-
下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯;催化剂加热条件下通入H2;
②除去溴苯中的溴,氢氧化钠溶液洗涤,分液;
③除去工业酒精中的水,足量生石灰,蒸馏;
④除去乙炔气体中的H2S杂质; CuSO4溶液,洗气;
⑤提纯苯甲酸;加热溶解、趁热过滤;冷却结晶、过滤、'洗涤、干燥;
A. ①②③④ B. ②③④⑤ C. ①②④⑤ D. ①③④⑤
-
随着人们的物质生活水平的不断提高和工业化快速发展,环境污染也日益加重,空气中有毒气体主要包括SO2、CO、NOx、烃类等等。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和水。已知CH4 和S的燃烧热ΔH分别为-890 kJ /mol 和-297 kJ /mol,则CH4和SO2反应的热化学方程式为_________________________________________。
(2)在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应:CO(g)+2H2(g) CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。


①P2及195℃下,在B点时,v(正)_____v(逆)(填“>”、“<”或“=”)。
②该反应的ΔH_________0(填“>”、“<”或“=”),原因是______________________________。
③在0~2 min,平均反应速率v(CH3OH)=______________________。(数值用小数形式表示)
④在P2及195 ℃时,该反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果用含P2的分式表示)。
(3)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见图所示。

①气体A中除了O2外,一定还含有的气体是________。
②该电池的负极反应式为__________________________。
-
(15分)甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
已知:①CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为__________________________;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入_____(填“CH4”或“O2”),b处电极上发生的电极反应式是______________;
②电镀结束后,装置Ⅰ中KOH溶液的浓度________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗氧气________L(标准状况下)。
CO(g)+H2(g),此反应是吸热反应。
CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:







